您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-18 16:40
〔摘要〕进行脱钙处理的常规石蜡包埋组织切片,会对骨缺损修复过程中矿化程度的研究造成一定的影响,可能导致骨修复关键信息的丢失。在与骨整合相关的骨修复材料的实验研究中,采用不脱钙骨组织病理切片技术可能具有独特的优势,其已被广泛应用于骨修复材料的临床前动物实验研究中。该研究就含植入物不脱钙骨组织病理切片技术及该技术在骨修复材料的骨组织工程研究中的应用情况作简要概述。
〔关键词〕不脱钙骨组织;硬组织切磨技术;骨修复研究
对骨修复材料进行动物实验研究时,连带植入物进行病理组织切片,可以更好地研究植入的骨修复材料的修复效果,更利于观察修复材料与骨组织界面的结合情况。植入的骨修复材料及骨组织的质地都很坚硬,如果使用常规石蜡包埋组织切片,需要先剔除植入物,再对骨组织进行脱钙处理。人为剔除植入物,可能使原有的组织结构形态发生改变,对评价植入物与周边组织的结合情况造成一定的影响,最终影响后期的评价分析;脱钙处理会使组织细胞皱缩,同时会破坏骨的矿化结构。相较于以上技术,硬组织切磨技术具有多种优势:无需剔除植入物及进行脱钙处理,植入物-组织界面不会被破坏,保持了组织与植入物之间原有的组织结构形态,且完整地保存了骨组织的矿化结构,经染色处理后,可用于骨修复材料植入后的骨组织形态计量学及骨整合相关的研究。本研究主要介绍含植入物不脱钙骨组织病理切片技术在骨修复材料动物实验研究中的应用情况,以期为骨组织相关的基础研究提供参考。
1、含植入物不脱钙的骨组织病理切片制作技术
硬组织切磨技术主要是针对人工种植牙、骨和含植入物的骨组织、埋置有坚硬植入物的其他组织标本,或在动物实验阶段进行了亲骨荧光素标记的不能进行脱钙的骨组织,通过脱水、浸润、包埋处理,由硬组织切磨系统完成的组织病理切片制作技术。利用硬组织切磨技术制备的不脱钙骨组织病理切片,常被用于骨修复材料植入后的骨整合研究及骨形态计量分析中。
骨组织结构学研究主要借助病理染色技术进行,采用硬组织切磨技术制片的骨组织病理切片常用的组织显色方法有苏木精-伊红染色(hematoxylin-eosin staining,HE 染色)法、亚甲基蓝-酸性品红染色法、Goldner's 三色染色法、甲苯胺蓝染色法、Van Gieson 苦味酸-品红染色法和茜素红染色法。硬组织切磨技术是开展组织细胞染色技术、荧光标记技术及研究骨修复、骨代谢情况不可替代的研究方法。
2、硬组织病理切片的多种染色方法在骨组织形态学研究中的应用
2.1 HE染色法在硬组织病理切片中的应用
HE染色法(图1)在骨组织中主要用于观察植入界面周围炎性细胞及巨噬细胞的浸润情况、周边软组织的修复能力、植入物与骨组织的骨结合率、可降解及可吸收植入物的组织反应过程及最终的结局。严乌毛等[1]在延期负重加载条件下纳米氟磷灰石/聚醚醚酮(nano-fluorapatite polyetheretherketone,nFA/PEEK)新型种植材料骨结合效能的研究中,将植入物植入比格犬下颌骨前磨牙区,实验结束后将含植入物的骨组织经光固化聚合树脂包埋后,采用硬组织切磨技术制作不脱钙骨组织病理切片,经HE 染色,进行了骨结合率的测定,即在镜下测量种植材料与骨组织接触的长度及植入物骨内界面的长度,然后进行统计学分析,结合其他实验结果判定材料的良好生物相容性。韩雪等[2]在犬骨髓基质细胞复合纳米晶羟基磷灰石/胶原/硫酸钙(nano-hydroxyapatite/collagen/calcium sulfate hemihydrates,nHAC/CSH)裸鼠皮下成骨的实验研究中,将构建的组织工程骨植入裸鼠皮下组织,4周后取材,制作不脱钙骨组织病理切片,在镜下可清楚看到 HE染色的复合体中的骨小梁、成骨细胞及破骨细胞,证明该复合体可促进骨组织的形成。HE染色法作为病理学中的基础染色方法,能够较好地评价种植材料的生物相容性和安全性,尤其是在含植入物的骨组织中,不脱钙的切磨处理方式能够最大限度地还原材料
与组织的接触和组织反应情况。但是,HE染色法无法较全面地评价含植入物的骨组织中纤维、软骨及新骨的形成情况,所以,对含植入物的骨组织,常结合其他特殊染色法进行分析。
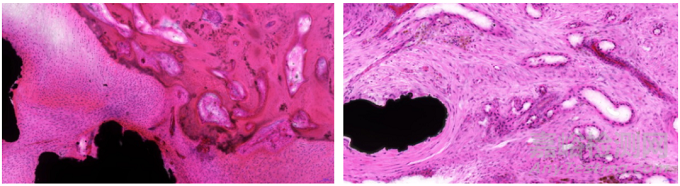
图1 羊脊椎骨植入(HE染色)
亚甲基蓝-酸性性品红染色法(图 2)可以比较清楚地显示骨组织中的成骨细胞、类骨质及新生骨组织,组织颜色对比明显,较适用于测量植入物与骨结合的面积及研究骨缺损后成骨及软组织的情况[3]。陈卿等[4]在早期负重载荷下 nFA/PEEK 成骨性能的研究中,将植入物植入比格犬下颌骨前磨牙区,实验结束后取带植入物的骨组织标本,经乙醇脱水、Technovit7200 VLC 浸润包埋后,采用硬组织切磨技术制备不脱钙骨组织病理切片,经亚甲基蓝 - 酸性品红染色,研究植入物骨结合形态学,染色结果显示,原矿化骨小梁较粗大、色浅,新生骨小梁较细长、颜色较鲜艳呈深红色、成骨细胞核呈深蓝色、细胞基质呈淡蓝色、类骨质呈紫灰色。于惠等[5]在不同植入扭矩的牙种植体 - 骨结合界面的组织学研究中,将BLBⅢ牙种植体植入比格犬的下颌骨,实验结束后取带植入体的骨组织标本行不脱钙硬组织切磨技术进行制片,在镜下,经亚甲基蓝-酸性品红染色的含植入物的骨组织中可见明显的骨基质、破骨细胞及新骨形成,且颜色区分亦较明显。朱晓茹等[6]在采用动物模型观察高正加速度环境对口腔种植术后种植体-骨结合的影响研究中,将种植体植入新西兰白兔下颌切牙部位,实验结束后取种植体及周围骨组织标本,制备不脱钙骨组织病理切片,通过亚甲基蓝-酸性品红染色对种植体-骨结合率进行了研究,可见亚甲基蓝-酸性品红染色对于含植入物的骨组织中的成骨细胞、骨基质等的染色效果比HE染色更加直观,组织颜色对比更加明显,对评价骨缺损界面骨的生长、植入物与骨组织的组织反应具有重要的意义,更适用于观察骨结合情况。
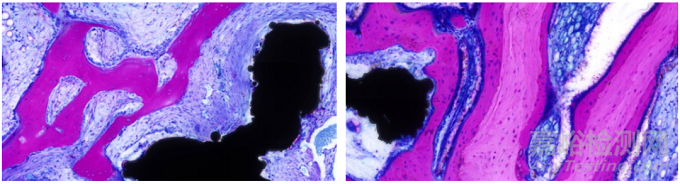
图2 兔股骨髁植入(亚甲基蓝-酸性品红染色)
Goldner's 三色染色法(图3 )较适用于骨缺损修复后新骨形成的过程观察,在Goldner's三色染色中,矿化骨被染成绿色,类骨质被染成橙色或橙红色,而软骨被染成紫色或蓝色。韩雪等[7]在经微弧氧化碱热处理后修复种植体周围骨缺损的愈合情况的研究中,采用犬下颌前磨牙区制备骨缺损,修复种植体植入缺损区,制备不脱钙骨组织病理切片,经Goldner's三色染色,观察了种植体周围骨缺损区的修复情况。杨力硕等[8] 在自体牙骨粉与异种牛骨粉修复牙槽骨缺损的对比研究中,选取家兔上颌中切牙牙槽窝为植入部位,制备不脱钙骨组织病理切片,采用Goldner's三色染色法,观察了骨组织及类骨质的形成情况,在该实验中,通过不同周期骨粉修复骨组织的Goldner's 三色染色对比,可明显观察到组织切磨面的新生骨组织的形成情况,在4周时,被染成蓝色的新生骨面积大,而在8周和12周的切片中,被染成蓝色的新生骨面积逐渐减小,被深染的成骨细胞代替,然后与对照组进行比较,评价其新骨的形成速率。Goldner's三色染色法是基于染料分子大小对结构致密、渗透性低或结构疏松、渗透性高的骨组织穿透效果不同进行染色的方法。因Goldner's三色染色法具有独特的染色优势,所以被作为含植入物的骨组织的修复中比较常用的评价方法。但是,Goldner's三色染色法中,新骨的颜色与Bio-oss骨粉的成骨材料颜色相近,所以,如果植入物是Bio-oss骨粉,则在观察骨修复时应慎重选择此方法。
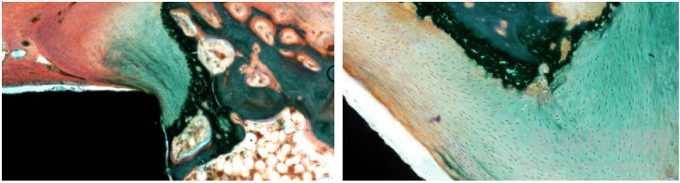
图3 羊脊椎骨植入(Goldner's三色染色)
软骨中含硫酸软骨素,而甲苯胺蓝属于嗜碱性染料,软骨细胞及其基质、成骨细胞等细胞成分会被染成蓝紫色,所以甲苯胺蓝染色法(图4)适用于骨缺损修复后新、旧骨的对比观察及对新骨数量的研究。钟建鑫等[9]在评价多孔钽颗粒对下颌骨骨缺损的修复效果的研究中,于比格犬下颌骨缺牙区构建颌骨骨缺损模型,将多孔钽颗粒及Bio-oss骨粉分别植入骨缺损区,实验结束后,制备不脱钙骨组织病理切片,经甲苯胺蓝染色后,对骨修复材料与骨组织结合情况及周边骨组织成熟程度进行了研究。薛喆等[10]在经典孔隙结构钛合金内置物在兔肱骨近端大结节处骨长入的初步组织学研究中,将钛合金螺钉植入制备的骨缺损模型区,实验结束后取含植入物的骨组织标本,使用Technovit7200 VLC光固化树脂浸润、包埋后,利用EXAKT硬组织切磨系统制备不脱钙骨组织病理切片,经甲苯胺蓝染色,观察随着时间的演变内置物中骨长入的情况。靳夏莹等[11]在评价富血小板纤维蛋白单独用于上颌窦提升种植骨再生效果的研究中,在制备富血小板纤维蛋白后,以犬上颌第一磨牙区为研究部位,实验结束后骨组织标本经树脂包埋后制备不脱钙骨组织病理切片,经甲苯胺蓝染色,于光学显微镜下观察了新骨形成情况。甲苯胺蓝染色法是含植入物骨组织中非常常用的形态学及病理学研究方法,不仅可以观察新生组织的钙盐沉积情况,统计成骨细胞数量,还常用于观察骨缺损和样品与组织之间的一些病理改变[12],如能够在镜下看到坏死钙化的软骨组织及胶原纤维增生等,从而评价植入物周围骨再生的效果及生物相容性。
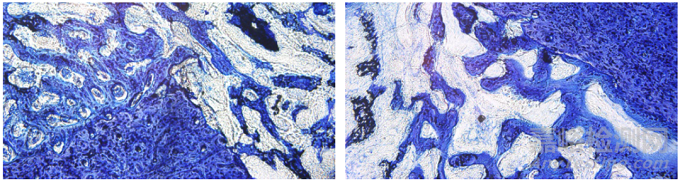
图4 兔股骨植入(甲苯胺蓝染色)
Van Gieson苦味酸-品红染色原理与染料分子大小和组织渗透有关,可将骨组织染成红色,将胶原纤维、肌纤维等染成黄色(图5),在骨植入实验中用来观察类骨质的形成及植入体与周围骨组织的整合程度等。王勇平等[13]在探讨塑料包埋技术结合四环素荧光标记制作不脱钙骨组织切片的实验研究中,选取兔股骨为研究部位,进行塑料包埋,制备不脱钙骨组织切片,经Van Gieson 苦味酸-品红染色后显示红色区域为成熟骨组织,黄色区域为未矿化的类骨质。胡腾龙等[14]在显微CT设定不同阈值范围对评价生物活性玻璃在体内成骨结果的影响研究中,采用新西兰大白兔股骨髁缺损模型,植入生物活性玻璃,实验结束后,组织标本制作为不脱钙骨组织病理切片,经Van Gieson 苦味酸-品红染色,最后使用IPP软件分析红色部分即新生骨组织在总面积中的占比,然后进行相关性分析,探究植入物的成骨性能差异。Van Gieson 苦味酸-品红染色由于在染色时需临时配制,放置一段时间后酸性品红不易着色,且切片较易褪色(应在染色后尽快保存及分析图像),所以在实际应用中较其他特殊染色法使用频率略少。
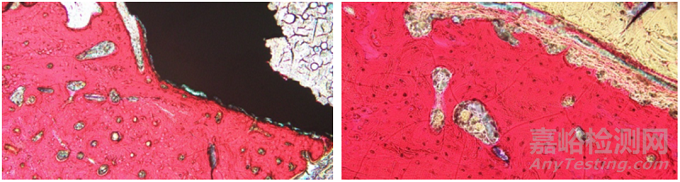
图 5 兔股骨植入(Van Gieson 染色)
茜素红属于阴离子染料,可与诸多(钙、钛、铝、锆等)阳性金属离子发生显色反应,形成“钙结节”。在骨组织中茜素红与钙离子形成红色或者橘红色的螯合物,并且颜色越深,表示该部位的骨组织钙盐沉积越多,所以常被用来染矿化的骨组织[15]。通过含植入物骨组织的茜素红染色(图6),能够较形象地描述不同周期不同部位的含植入物骨组织中钙盐的沉积情况。Wise和Winkelmann[16]利用Micro-CT和茜素红染色相结合评估了羟基脲对荷兰兔胎儿骨骼的影响,结果显示,Micro-CT和茜素红染色都能够很清晰地观察到羟基脲对于胎儿骨骼的畸变效果,但是,Micro-CT对于钙化程度不是很高的骨组织(边缘位置或者新的骨组织即将形成及缺损)成像结果不明显,而结合茜素红染色则能够观察到骨组织中一些轻微的钙化情况。
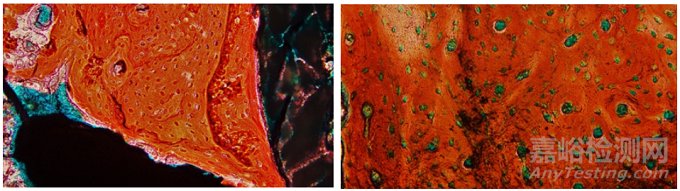
图6 兔股骨植入(茜素红染色)
亲骨荧光素是指能够与骨组织中钙离子特异性结合的荧光染料,比较常用的有四环素、茜素络合酮、钙黄绿素(图7)等,注入体内后,可以与骨组织尤其是新生的骨组织相结合,经不脱钙硬组织切磨技术制备组织切片后,由特定波长激发,可在荧光显微镜下将示踪的骨组织呈现出来[17]。
宋亚平等[18]在三种复合型骨移植材料早期修复骨缺损的比较研究中,于比格犬胫骨干骺端制备骨缺损,将骨修复材料植入缺损区域,实验过程中,皮下分别注射盐酸四环素、钙黄绿素、茜素红进行体内荧光标记,实验结束后将骨组织标本制备成不脱钙骨组织病理切片,用于测量荧光标记率,对新生骨形成量进行了研究。周宏志等[19]在荧光标记法对“脑回形”微弧氧化表面植入物早期骨结合的评价研究中,于兔股骨髁部植入植入体,实验过程中皮下注射钙黄绿素,进行体内茜素红-钙黄绿素双色荧光标记,实验结束后取骨组织标本制备不脱钙骨组织病理切片,对骨组织矿化速率进行了研究。
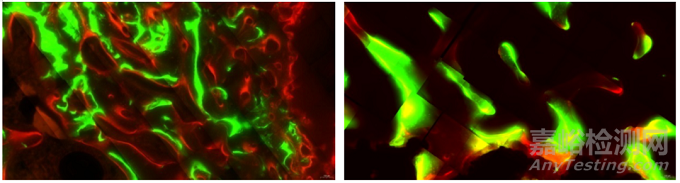
图7 股骨髁植入(茜素红和钙黄绿素标记)
通常情况下,在免疫组化染色中,骨组织几乎都需要进行脱钙处理,而对于不脱钙骨的免疫组化染色,因制片难度高,制片方式不同于软组织或者脱钙后的骨组织,并且骨组织中含大量钙盐,所以对含植入物不脱钙骨组织的免疫组化染色研究相对较少。然而李剑等[20] 利用改进的低温甲基丙烯酸甲 酯(methyl methacrylate,MMA) 包埋SD大鼠胫骨,制备不脱钙骨切片,最后进行免疫组化和原位杂交,顺利观察到了切片中的阳性表达,让含植入物的硬组织切片的免疫组化染色成为可能。Knabe 等[21]在评价植入物的成骨性能中,利用乙醇固定取代甲醛,并用聚甲基丙烯酸甲酯和聚甲基丙烯酸丁酯混合包埋,最后进行不脱钙的切片,经免疫组化染色,成功检测到了阳性信号。Yang等[22]在2019年与密歇根大学牙科学院生物与材料科学系联合发布的一篇文章中,利用4%多聚甲醛(paraformaldehyde,PFA)固定,8%明胶包埋来处理未脱钙的小鼠颅面组织,然后进行SOX9免疫染色、OSX和E11/Podoplanin 双重免疫染色,均能够在细胞中检测到阳性表达。Fujihara 等[23]在利用未脱钙骨组织的冷冻切片来探究异位矿化的骨组织形态学中,同样使用免疫组化对ENPP1突变小鼠进行定量评估,其样本用0.3% 过氧化氢处理,在用马血清封闭后,用3,3'-二氨基联苯胺四盐酸盐和过氧化氢显色,最后获得了具有阳性反应的切片。在硬组织的制片过程中,包埋经常要求温度为45~55℃,且时间较长,容易导致抗原性丧失,而通过低温包埋或冷冻骨组织切片技术及聚甲基丙烯酸甲酯包埋甚至明胶包埋、过氧化苯甲酰等的聚合,能够较好地维持骨组织的抗原活性,不脱钙骨组织即能够进行免疫组化染色,对植入材料及骨组织进行定位或定量研究具有重要的意义。但是,不脱钙骨组织的免疫组化亦有明显的缺点,如硬组织切片一般较厚,有时抗体无法渗透进下层组织,可能会导致染色不均或假阴性,钙盐的沉积也可能造成冲洗困难等,以上情况会导致整个免疫组化的染色时间及抗体量较难控制。
3、骨组织形态计量学
骨组织形态计量学是在不脱钙骨组织病理切片技术及活体荧光标记技术的基础上,在二维的不脱钙骨组织病理切片图像上利用体视学方法,推导出反映骨重建、骨结构的三维参数,即动态参数及静态参数的研究方法,测定对象为不脱钙的骨组织或是在动物实验阶段进行荧光标记的骨组织标本。
采用不脱钙硬组织制片技术制备组织切片并进行形态学定量分析,可同时测定骨组织形态结构的静态参数和动态参数。静态参数用来描述骨量的多少和骨小梁的形态,可对描述骨小梁面积、厚度、分离度参数等信息进行定量分析。在对动物活体进行荧光标记后,可测量的动态参数包括骨吸收参数和骨形成参数,通过以上参数可以了解骨表面矿化量和矿化速率。黎永奇等[24] 在观察HU-308药物缓释涂层对骨质疏松大鼠植入物周骨密度、类骨质形成和骨吸收的影响研究中,将带植入物的大鼠胫骨制作成不脱钙骨组织病理切片,经甲苯胺蓝染色,对骨组织形态计量学参数(植入物螺纹内骨密度、类骨质周长百分数和骨吸收周长百分数)进行了测定、分析。
4、讨论
通常情况下,对不脱钙的骨组织及埋置有骨修复等植入物的骨组织进行病理组织切片制作,可利用EXAKT硬组织切磨系统[25-26]。含植入物不脱钙骨组织病理切片技术制备的病理组织切片,保持了材料与骨结合界面的完整性,是研究结合界面的重要方法,已被广泛应用于骨修复材料的各种动物实验研究中,包括大动物非临床的实验研究。但是,其亦存在不足,如整个制片过程较为复杂,制片操作步骤烦琐,耗时长,且成本昂贵;材料与组织之间的硬度与密度并不完全一致,在硬组织脱水、浸透、包埋处理过程中造成材料与组织界面间隙变宽或变窄,容易引起界面结合假象;相较于软组织切片,难以把握染色过程(蚀刻过程等),想要获得理想的染色切片具有一定的难度。
不同染色方法的特点和侧重点各不相同,能够具体应对不同的研究目的。对植入物与组织界面的研究,应根据植入物及观察的组织不同选择染色方法,甚至结合脱钙骨的软组织切片染色,以期得到可靠的形态学、组织学评价依据。武登诚和李盛林[27]在介绍口腔医学中对硬组织切磨技术的应用中,利用 HE和甲苯胺蓝染色硬组织切片,并对比观察了植入界面的骨性接触与纤维走向;Yang等[22]用HE染色和免疫荧光染色对比分析了抗体在组织中的具体阳性表达位点。HE染色主要是观察植入物诱发的骨组织的组织反应,侧重评价其基本的生物相容性;亚甲基蓝-酸性品红染色主要观察成骨细胞及新生骨等,侧重评价骨生成、骨结合率及计算成骨面积;Goldner's三色染色主要观察软骨、类骨质及矿化骨,侧重骨组织修复,对于不同周期的矿化程度观察对比明显[28];甲苯胺蓝染色主要观察新骨形成、骨细胞、骨基质及一些病理改变,侧重骨修复观察,而且新生骨和成熟骨之间界限清晰;Van Gieson 苦味酸-品红染色主要观察骨组织和胶原纤维,侧重植入物与组织的整合程度;茜素红染色主要观察骨组织钙盐沉积;亲骨荧光素标记主要用于示踪,特别是对于新骨形成、骨代谢等进行定量分析;而免疫组化主要确定骨组织中的抗原,从而进行异位矿化定性、定量研究[3,29]。因每种染色方法均存在不足,所以在实际应用中应结合多种染色方法进行观察研究。
骨修复材料的骨整合研究主要是对生物学(组织学、细胞和分子生物学)方面、医学影像学方面及生物力学方面进行评价分析[30]。对骨组织形态结构进行分析研究的方法很多,基于影像学技术的骨组织结构形态分析方法具有无创、对样本损伤小的优点,在对骨组织性质的评价研究中优先被选用[31]。赖春花等[32]对显微CT与硬组织切片技术在评价牙种植体骨结合中应用的对比研究中发现,显微CT可以宏观地观察到种植体周围骨质的情况,但对种植体-骨界面成骨现象显示不够清晰,经不脱钙硬组织切片组织病理染色后其对种植体-骨界面的细微情况显示较清晰。针对一些复杂的含植入物的骨组织,显微CT能够构建出三维的形态,对组织进行立体分析。Palmquist等[33]利用显微CT及不脱钙骨组织的甲苯胺蓝染色,评估3D打印的多孔 Ti6Al4V植入的骨形成情况,发现通过甲苯胺蓝染色的含植入物组织在定量组织形态计量学中与显微CT的3D测量结果有高度的相关性;Liu等[34]在用形态计量学评价显微CT能否作为松质骨的3D评估分析方法时对比了HE染色结果,利用SPSS 16.0.1软件分析,发现显微CT与组织切片在骨体积密度、骨表面密度和小梁厚度等方面具有显著的相关性。因此,在对含植入物的骨形成研究中经常使用组织形态学和显微CT结合的方法来进行分析,确保结果更加可靠、立体。
尽管存在难点,但含植入物不脱钙骨组织病理切片技术和组织染色方法已成为评价骨整合的重要研究手段和不可或缺的一部分。
【参考文献】
[1]严乌毛,陈卿,魏杰,等.延期负载下nFA/PEEK种植材料的骨结合情况动态观察[J].口腔颌面外科杂志,2017,27(5):338-343.
[2]韩雪,周威,王东胜,等.犬骨髓基质细胞复合nHAC/CSH裸鼠皮下成骨的实验研究[J].中华老年口腔医学杂志,2015,13(3):129-131.
[3]王东胜,吕燕,王兴.不脱钙骨及种植体骨磨片不同染色方法的选择与应用[J].中华老年口腔医学杂志,2015,13(6):321-324.
[4]陈卿,严乌毛,魏杰,等.早期负重载荷下nFA/PEEK种植体周成骨情况研究[J].口腔颌面外科杂志,2018,28(2):90-95.
[5]于惠,柳忠豪,许胜,等.不同植入扭矩的牙种植体-骨结合界面的组织学研究[J]. 中国口腔种植学杂志,2017,22(2):57-59.
[6]朱晓茹,邓天政,逄键梁.高正加速度对口腔种植体骨结合影响的动物实验研究[J].实用口腔医学杂志,2018,34(4):486-490.
[7]韩雪,刘洪臣,王东胜,等.Bio-Oss与表面改性后钛铌镐锡修复种植体周围骨缺损的组织学研究[J].口腔颌面修复学杂志,2014,15(4):207-209.
[8]杨力硕,闫建伟,郑辉,等.自体牙骨粉与异种牛骨粉修复牙槽骨缺损的对比研究[J].华西口腔医学杂志,2018,36(4):372-377.
[9]钟建鑫,节云峰,罗金英,等.多孔钽颗粒在下颌骨缺损修复中的作用[J]. 第三军医大学学报,2015,37(12):1277-1280.
[10]薛喆,宋关阳,李奉龙,等.经典孔隙结构钛合金内置物在兔肱骨近端大结节处骨长入的初步组织学研究[J].中华肩肘外科电子杂志,2018,6(1):47-52.
[11]靳夏莹,那日苏,郑辉,等.评价富血小板纤维蛋白单独用于上颌窦提升种植骨再生的效果[J].中国组织工程研究,2017,21(26):4149-4154.
[12]潘琳,白彦萍,蔡哲,等.实验病理学技术图鉴[M].北京:科学出版社,2012 :428-429.
[13]王勇平,李晓琴,张辉,等.塑料包埋结合四环素荧光标记制作不脱钙骨组织切片的实验研究[J].临床与实验病理学杂志,2012,28(5):543-545.
[14]胡腾龙,杨柳,颉强.显微CT设定不同阈值范围对评价生物活性玻璃在体内成骨结果的影响[J].骨科,2018,10(6):539-543.
[15]Bensimon-Brito A, Cardeira J, DionísioG, et al. Revisiting in vivo staining with alizarin red S--a valuable approach to analyse zebrafish skeletal mineralization during development and regeneration[J].BMC Developmental Biology, 2016, 16: 2.
[16]Wise LD, Winkelmann CT.Evaluation of hydroxyurea-induced fetal skeletal changes in Dutch belted rabbits by micro-computed tomography and alizarin red staining[J].Birth Defects Research (Part B), 2009, 86(3): 220-226.
[17]吴涛,刘英超,郭志旺,等.亲骨荧光素间接标记软骨内成骨的早期血管新生[J].中国组织工程研究,2017,21(8):1192-1196.
[18]宋亚平,陈传耀,温璞,等.三种复合型骨移植材料早期修复骨缺损的比较[J].中国口腔种植学杂志,2018,23(2):51-56.
[19]周宏志,刘琳,陈小冬,等.荧光标记法对“脑回形”微弧氧化表面种植体早期骨结合的评价[J].口腔颌面修复学杂志,2016,17(5):271-276.
[20]李剑,廖二元,魏启幼,等.不脱钙骨组织免疫组织化学与原位杂交的方法研究[J].湖南医科大学学报,2003,28(6):601-604.
[21]Knabe C, Kraska B, Koch C, et al. A method for immunohistochemical detection of osteogenic markers in undecalcified bone sections[J]. Biotech Histochem, 2006, 81(1): 31-39.
[22]Yang J, Pan H, Mishina Y. Tissue Preparation and Immunostaining of Mouse Craniofacial Tissues and Undecalcified Bone[J]. J Vis Exp, 2019, 5(10): 147.
[23]Fujihara R, Chiba Y, Nakagawa T, et al. Histomorphometry of ectopic mineralization using undecalcified frozen bone sections[J]. Microsc Res Tech, 2018, 81: 1318-1324.
[24]黎永奇,李栋健,冯青,等.HU-308药物涂层对骨质疏松大鼠种植体周骨组织影响的实验研究[J].口腔颌面修复学杂志,2015,16(1):14-18.
[25]齐进,黄萍,张连方,等.EXAKT 切磨系统在带金属种植体软硬组织切片中的应用[J].中国组织工程研究,2012,16(35):6555-6559.
[26]贺韬,曹聪,董宇启.硬组织工程材料骨整合评价方法与应用[J].国际骨科学杂志,2012,33(2):92-95.
[27]武登诚,李盛林.软硬组织切磨技术在口腔医学研究中的应用[J].北京大学学报(医学版),2007,39(1):94-95.
[28]范芹,徐世同,刘建国,等.3种特殊染色法显示种植体骨磨片组织学效果比较[J].广东牙病防治,2012,20(6):285-287.
[29]Goldschlager T, Abdelkader A, Kerr J, et al. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis[J]. J Vis Exp, 2010(35): S52-S58.
[30]Bloch SL, Kristensen SL, Sørensen MS. The viability of perilabyrinthine osteocytes: a quantitative study using bulk-stained undecalcified human temporal bones[J]. Anat Rec (Hoboken), 2012, 295(7): 1101-1108.
[31]吕厚辰,唐佩福.骨组织形态及微观结构的影像学评价及进展[J].中华骨质疏松和骨矿盐疾病杂志,2016,9(1):68-73.
[32]赖春花,周磊,徐淑兰,等.显微CT与硬组织切片技术在评价牙种植体骨结合中应用的对比研究[J].口腔颌面外科杂志,2016,26(3):195-201.
[33]Palmquist A, Shah FA, Emanuelsson L,et al. A technique for evaluating bone ingrowth into 3D printed, porous Ti6Al4V implants accurately using X-ray micro-computed tomography and histomorphometry[J].Micron,2016,11:009.
[34]Liu H, Li W, Liu YS, et al. Bone micro-architectural analysis of mandible and tibia in ovariectomised rats: A quantitative structural comparison between undecalcified histological sections and micro-CT[J]. Bone Joint Res,2016, 5(6): 253-262.
作 者:朱福余1,袁暾2,张杰3,蒲林云2,车国喜1,刘成虎1,王昕1,王阁奇3,孙立魁1(通信作者),梁洁2(通信作者),金毅4(通信作者)
单 位:1 山东省医疗器械产品质量检验中心,山东省医疗器械生物学评价重点实验室,国家药品监督管理局生物材料器械安全性评价重点实验室,国家药品监督管理局药品包装材料质量控制重点实验室 (山东济南 250101);2 四川大学国家生物医学材料工程技术研究中心,四川医疗器械生物材料和制品检验中心,国家药品监督管理局生物材料器械安全性评价重点实验室 (四川成都 610064);3 深圳领先医疗服务有限公司 (广东深圳 518108);4 深圳市药品检验研究院·深圳市医疗器械检测中心,广东省药品监督管理局实验病理学重点实验室 (广东深圳 518057)

来源:医疗装备杂志


