您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-08-25 10:44
1、医疗器械基本化学信息收集和生成的意义
医疗器械材料组成和生产工艺中引入化学物质的定性和定量的信息是进行医疗器械生物学评价和毒理学风险评估的重要信息输入。对于原材料成分和配方信息的收集和生成有助于辅助可浸提物或可沥滤物研究来鉴定器械材料迁出的化学物质。这些信息可以辅助毒理学家更好的开展毒理学风险评估进而指导生物相容性试验,最终评价医疗器械及其材料相关的潜在安全风险。
2、需要收集哪些化学信息?
1)材料供应商提供的信息
a) 材料制造商或供应商的名称;
b) 材料通用商品名称;
例如:Silastic®、 Dacron®、Tetoron®、Pellethane®、尼龙、Teflon®等。
c) 化学标识符(如CAS号)或系统名称(IUPAC/USAN);
d)产品编码和编号;
例如:热塑性聚氨酯弹性体2393-80AE,聚甲基乙烯基聚硅氧烷 0215等;
e) 材料制造商的技术规范;
例如纯度、杂质特性和水平、质量、分子质量、分子质量分布、热性质、拉伸强度、洛氏硬度、弯曲模量、导电性等;
f) 材料组成和配方的详细信息;
如CAS号、每种化学物质在配方中的质量分数百分比(%)、每种化学成分的功能和每种化学物质的结构和配方;
g) 符合性证书(有区域概要)和相关全球法规(例如,REACH,间接食品添加剂)。
收集这些信息有助于我们更好的了解器械的材料组成以及材料的化学特性,进而辅助整个化学表征顺利进行。
2)化学分析提供的信息
a)非特异性分析,包括总有机碳含量(TOC),紫外吸光度(UV) 以及药典当中包括炽灼残渣、重金属以及高锰酸钾还原物质和蒸发残渣等可溶出物的试验方法和规范。这些分析有助于帮助医疗器械生产商评估器械材料的基本情况。
b)特异性分析,包括对医疗器械当中未知和已知的化学物质进行定性和定量分析,包括使用NMR,ATR/FTIR,GC-MS, LC-MS, ICP-MS等分析手段确定配方和浸提液中存在化学物质的水平。这些分析方法获得的数据结合毒理学风险评估可以更好的完善整个生物学评价内容。
3)材料和/或产品国家和国际标准
这些标准测试结果可应用于相关材料的质量要求,但这些标准是否适用于化学表征需要考虑标准是否规定了器械和患者的接触时间?是否规定了材料的应用范围?是否对化学物质的水平设定了限值?这些限值是否综合评价了器械的实际化学暴露量?通过标准的器械和材料是否具有安全临床使用史等。需要注意的是,材料标准的使用可能不足以解决制造和加工对最终器械中材料的影响,所以理论上来讲满足了标准测试的要求并不能完全代替医疗器械整体的化学表征结果。
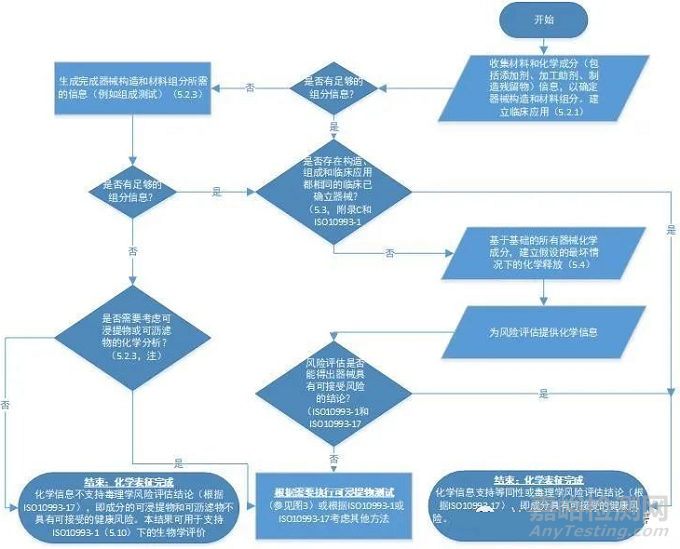
3、化学信息的生成
如果收集的化学信息不足以证明医疗器械的生物安全性,则需要对医疗器械和/或其建构材料进行组分测试,以补充所有信息空白,并提供关于材料和化学成分的必要定量信息。信息生成的流程如下图。值得注意的是一般情况下,利用器械或材料配方成分,建立假设的最坏情况下的化学释放,其毒理学评估结果往往不尽如人意,这种假设是建立在配方中的所有成分都进入到人体中开展的。因此更为接近实际临床情况的可浸提物和可沥滤物测试就显得尤为重要。例如对于加工助剂环己酮,如果按照生产当中实际添加量进行毒理评估,而不考虑环己酮的挥发情况和实际产品中的残留情况,往往毒理学风险评估后的结果是不可接受的,但是这并不意味着医疗器械是有生物安全性风险的,事实上是需要进行可浸提物和可沥滤物研究来评估其风险则更为接近实际情况。
参考文献:
<1> ISO10993-18:2020 Biological evaluation of medical devices — Part 18: Chemical characterization of medical device materials within a risk management process

来源:药明康德


