您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-12 14:14
近日,国家药监局批准了爱德华兹生命科学有限责任公司经导管主动脉瓣膜系统的产品注册,我们通过其医疗器械产品注册技术审评报告(点击下载)一起来了解下,该产品在临床前研发做了哪些实验。
一、产品概述
(一)产品结构及组成
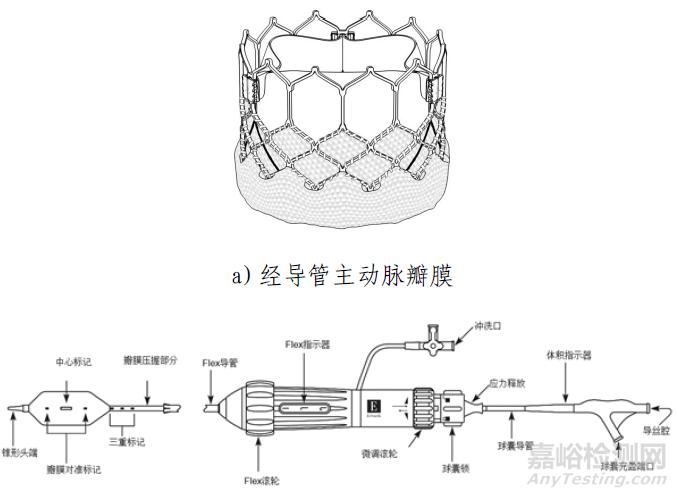
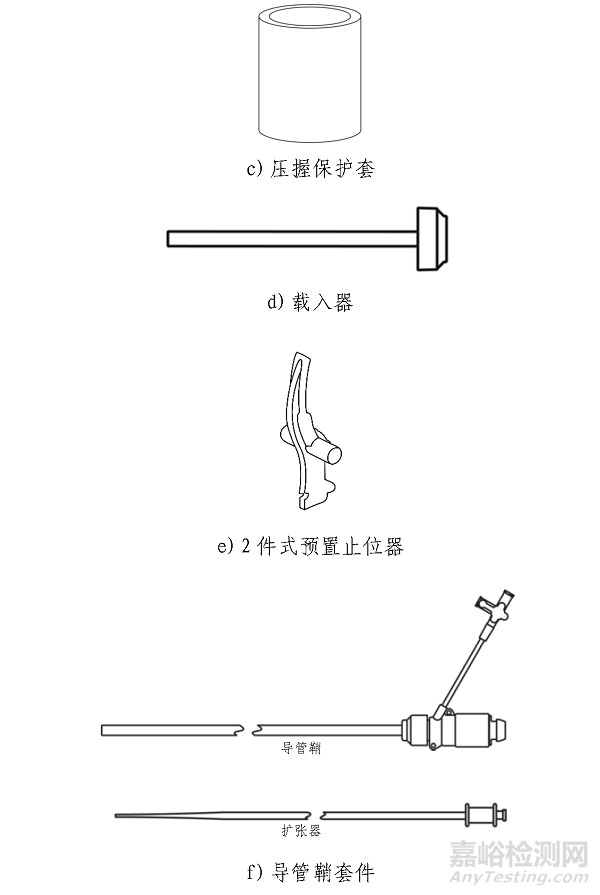
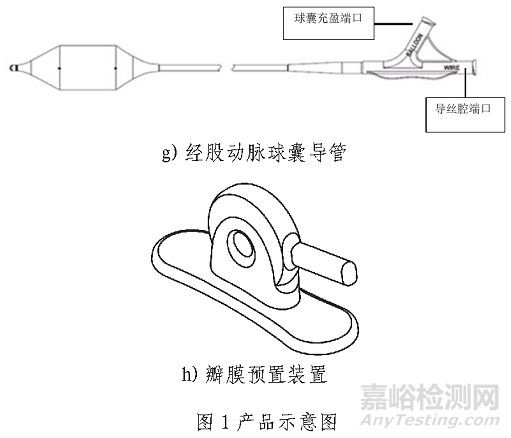
产品包括经导管主动脉瓣膜,经导管主动脉瓣膜输送系统,导管鞘套件,经股动脉球囊导管,瓣膜预置装置。瓣膜由牛心包瓣叶,钴铬合金瓣架,PET内外裙缘组成。瓣膜经化学液体灭菌,其余部件经环氧乙烷灭菌。一次性使用。
(二)产品适用范围
该产品适用于治疗由心脏团队(包括心血管外科医师)决定的外科手术高危或禁忌的(例如:根据美国胸外科医师学会(STS)评分系统评估外科手术风险≥8%或手术30天死亡率≥15%)症状性的重度钙化性自体主动脉瓣狭窄的患者。
(三)作用机理
该产品与自体主动脉瓣膜工作原理类似,在心脏舒张期间防止主动脉血液回流进入左心室。在正常瓣膜运行期间,当左心室中的压力超过主动脉压力时,主动脉瓣叶由于心室收缩而打开。在心脏收缩期间,血液通过开放的主动脉瓣从左心室流到主动脉。排空左心室后,扩张的主动脉中升高的压力将血液推回至左心室,导致瓣叶闭合,从而防止血液在心脏舒张期间流回心室。
经导管主动脉瓣膜输送系统用于输送和展开瓣膜。使用瓣膜预置装置、压握保护套和预置止位器将瓣膜预置到输送系统的瓣膜压握部分。使用球囊锁调节将预置的瓣膜/输送系统固定到默认位置,并插入载入器以便进入Edwards导管鞘套件。带有瓣膜的输送系统通过导管鞘插入,导管鞘设计有折叠缝以暂时扩张并容纳插入的器械,并通过血管系统进行跟踪。载入器管路有穿孔,并且可以剥离以允许完全插入输送系统。输送系统上的flex滚轮用于在追踪期间控制输送系统的弯曲。当瓣膜定位在降主动脉中时,球囊锁调节用于将输送系统从默认位置移至瓣膜对准位置,从而使收到能够被放置在输送球囊上。微调滚轮用于精细调节球囊内的瓣膜对准标记之间的收到位置。组件推进到狭窄主动脉瓣部位。充盈球囊,在瓣环内扩张并展开收到回缩Commander输送系统,返回至默认位置,然后通过eSheath取出。
二、临床前研究摘要
(一)产品性能研究
1. 产品技术要求研究
1)经导管主动脉瓣膜
外观
尺寸
脉动流试验
静态前向流试验
稳态泄漏试验
耐腐蚀性
抗挤压性能(平板)
植入缩短率
回缩性能
径向支撑力
射线可探测性
缝线标记
缝线褪色试验
缝线抗张强度
化学成分和晶粒度
瓣膜疲劳试验
瓣架疲劳试验
瓣架厚度
热皱缩温度
瓣膜抗位移性能
酸碱度
重金属
戊二醛残留
无菌
热原
2)经导管主动脉瓣膜输送系统
外观
规格尺寸
导丝兼容性
水合性判定
无泄漏
峰值拉力
冲洗管的连接牢固度
射线可探测性
Y形接头和三通阀的圆锥接头
球囊充压和卸压时间
球囊爆破压力
球囊额定疲劳
载入器外观
载入器规格尺寸
载入器连接牢固度
载入器配合性能
压握保护套外观
压握保护套尺寸
压握保护套配合性能
止位器外观
止位器配合性能
尖端构型
追踪性
压握直径
推送力
扭转性
释放力
释放时间
输送系统球囊直径与充盈体积的关系
植入物与球囊充盈体积的关系
抗弯曲/扭折能力
止血阀密封无泄漏
模拟使用
分离力
色泽
酸碱度
蒸发残渣
重金属
紫外吸光度
还原物质
环氧乙烷残留
无菌
热原
3)导管鞘套件
导管鞘外观
导管鞘尺寸
导管鞘无泄漏
止血阀无泄漏
导管鞘断裂力
导管鞘三通接头连接牢固度
导管鞘三通接头的圆锥接头
导管鞘射线可探测性
扩张器外观
扩张器尺寸
扩张器断裂力
扩张器座
扩张器射线可探测性
色泽
酸碱度
重金属
紫外吸光度
环氧乙烷残留
无菌
热原
4)经股动脉球囊导管
外观
规格尺寸
水合性判定
无泄漏
峰值拉力
射线可探测性
圆锥接头
色泽
酸碱度
蒸发残渣
重金属
紫外吸光度
还原物质
环氧乙烷残留
无菌
热原
5)瓣膜预置装置
外观
压握保护套与瓣膜和瓣膜预置装置配套使用时,压握保护套应无破损
压缩力
压缩孔径
重复使用性能
环氧乙烷残留
无菌
热原
2. 产品性能评价
瓣膜性能包括MRI兼容性、瓣膜耐久性研究、瓣架疲劳、动态失效模式研究、瓣膜抗位移、植入物短缩率、回缩性能、瓣架抗断裂性、径向抗挤压性能、平板抗挤压性能、可视性、流体力学性能(脉动流、静态前项流、稳态泄漏)、电化学腐蚀、尺寸验证、模拟使用等。输送系统性能包括外观、尺寸、尖端构形、不透射线、导管偏转角、导丝兼容性、输送力、瓣膜对准回拉力、定位、回撤后瓣膜移动情况、扭矩及球囊推出力、球囊充盈回缩时间、充盈期间瓣膜定位、充盈压力、回撤力、展开瓣膜尺寸、无泄漏、球囊疲劳及爆破、输送系统扭结半径、连接强度、拉伸强度、不溶性微粒、器械间兼容性等。导管鞘性能包括外观、尺寸、不透涉嫌、导丝兼容性、扩张验证、止血、鞘管扭结试验、装载器剥离、粘合强度等。经股动脉球囊导管性能包括外观、尺寸、导丝兼容性、球囊导管推进力、可追踪性、尺寸、球囊充盈回缩时间、回撤力、射线不透性、球囊疲劳性、扭结抗力、抗拉强度、耐腐蚀性、球囊爆破、充盈体积直径与压力关系、管身管座连接强度等。预装装置性能包括外观、手柄锁定、闭合孔径、预置力、开启孔径、周期试验等。上述研究结果表明产品符合设计输入要求。
(二)生物相容性
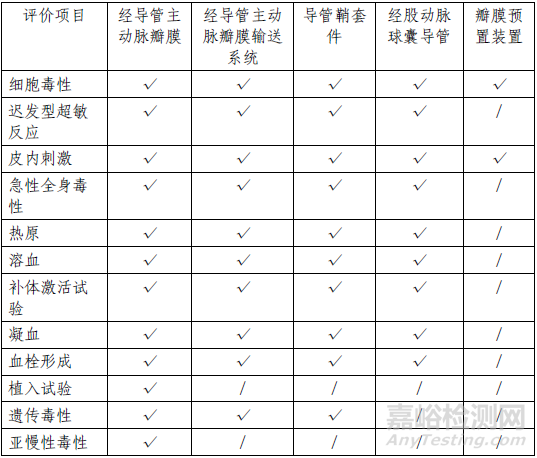
该产品包括经导管主动脉瓣膜、经导管主动脉瓣膜输送系统、导管鞘套件、经股动脉球囊导管和瓣膜预置装置五个部分,其中瓣膜为植入器械,与循环血液长期接触;输送系统、导管鞘套件和经股动脉球囊导管为外部接入器械,与循环血液短期接触。瓣膜预置装置不与人体接触。申请人按照GB/T 16886系列标准对所有部件分别进行了生物相容性评价,产品的生物相容性风险可接受,具体评价项目详见表3。
表3生物相容性评价项目表
(三)生物安全性
该产品的瓣膜釆用了牛心包。申请人从原材料选取、原材料获取、原材料和供应商管控、生产过程管控、产品处理工艺方法控制、质量体系保证等方面进行了论述,并参照动物源性医疗器械注册技术审查指导原则等要求对瓣膜的抗钙化性能,以及瓣膜的免疫原及病毒灭活性能进行了验证,结果符合要求,相关生物安全性风险可控。
(四)灭菌
该产品包括经导管主动脉瓣膜、经导管主动脉瓣膜输送系统、导管鞘套件、经股动脉球囊导管和瓣膜预置装置五个部分。其中瓣膜部分釆用了化学液体灭菌方法,剩余的部件均釆用环氧乙烷灭菌,无菌状态提供。申请人分别提交了各部件的灭菌过程确认报告,无菌保证水平可达10-6。提供了瓣膜清洗验证、各相关化学物质残留验证资料。
(五)产品有效期和包装
经导管主动脉瓣膜系统标称有效期为19个月。申请人提供了货架有效期验证报告。其中经导管主动脉瓣膜、经导管主动脉瓣膜输送系统、导管鞘套件、经股动脉球囊导管验证实验为实时老化,包括产品稳定性、包装完整性和运输模拟验证;瓣膜预置装置验证实验为加速老化,包括产品稳定性、包装完整性和运输模拟验证。
(六)动物研究
申请人开展了绵羊等模型的动物实验研究以确认产品使用性能及安全性。评价指标包括有效性指标(瓣膜假体的急性功能、输送系统的急性性能以及瓣膜假体的短期、中期和长期血液动力学性能)和安全性指标(瓣膜假体的长期生物学反应)。动物实验结果表明,产品达到预期设计要求。

来源:未知


