您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-07 09:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
华海拉莫三嗪片首家通过一致性评价。华海药业4类仿制药拉莫三嗪片获国家药监局核发的《药品注册批件》,成为该品种首家通过一致性评价的产品。拉莫三嗪片主要用于治疗癫痫,原研产品由葛兰素史克研发,于1999年获批进口中国。此前,国内药企中仅有湖南三金制药拥有该品种的批文。2019年在中国公立医疗机构终端化学药抗癫痫药产品TOP20格局中,拉莫三嗪片排在第6位。
今日头条
国内药讯
1.石药小儿碳酸钙D3颗粒即将获批。石药欧意药业按仿制6类报产的小儿碳酸钙D3颗粒在审状态更新为“已发件”,预计即将获批上市。碳酸钙D3适用于妊娠期、哺乳期、更年期妇女、老年人、儿童等人群的钙补充剂,并帮助防治骨质疏松。目前国内市场碳酸钙D3剂型有片剂及颗粒剂,其中拥有碳酸钙D3颗粒剂生产批文的企业有6家。2018年中国公立医疗机构终端及城市零售药店终端碳酸钙D3销售额为58.4亿元。
2.亚盛医药第三代BCR-ABL抑制剂获孤儿药资格。亚盛医药第三代BCR-ABL抑制剂HQP1351获FDA授予孤儿药资格,用于治疗慢性髓性白血病(CML)。HQP1351是中国首个三代BCR-ABL靶向耐药CML治疗药物,目前正在中国开展治疗T315I突变的慢性期和加速期的CML患者的两项关键Ⅱ期试验,并已启动第三项针对一代及二代TKI耐药/不耐受患者的关键性Ⅱ期研究。亚盛医药计划今年在中国递交HQP1351的新药上市申请,该产品预计将成为亚盛医药首个上市产品。
3.GSK重磅ADC药物在中国申报临床。葛兰素史克抗体偶联药物(ADC)belantamab mafodotin的临床试验申请获CDE受理。该药已向FDA递交了治疗复发难治多发性骨髓瘤的上市申请。如果获批,belantamab mafodotin将成为FDA批准的首个靶向B细胞成熟抗原的药物。它曾获FDA授予的突破性疗法认定、优先审评资格,以及欧洲药品管理局的PRIME认定。在一项关键性Ⅱ期临床DREAMM-2中, belantamab mafodotin 2.5mg/ kg剂量组的总缓解率达31%,3.4mg/kg剂量组的ORR达34%。
4.武田罕见病新药maribavir在华获批临床。武田具 “best-in-class”潜力的maribavir(TAK-620)片在中国获批一项临床试验,适应症为:用于治疗巨细胞病毒(CMV)感染或疾病。Maribavir是武田收购夏尔(Shire)获得的一款UL97蛋白激酶抑制剂,曾被FDA授予治疗移植患者巨细胞病毒(CMV)感染的突破性疗法认定。此外,maribavir还在美国和欧盟获得孤儿药资格,用于治疗高危患者人群(移植等)的严重巨细胞病毒感染以及用于免疫受损患者的巨细胞病毒感染。目前该新药尚未在任何国家和地区获批上市。
5.德琪医药与Karyopharm公司就4款产品扩大合作。德琪医药宣布与Karyopharm公司就Karyopharm的4款产品签署扩大合作协议。德琪此前拥有Xpovio和eltanexor所有肿瘤适应症在中国大陆和澳门的开发、生产与商业化的权益,以及KPT-9274所有肿瘤适应症、verdinexor非肿瘤适应症在中国大陆和港澳台、韩国和东盟国家的开发、生产与商业化的权益。根据此次扩大合作协议,德琪医药还将获得在澳大利亚、新西兰、韩国、中国香港和台湾地区、东盟国家开发、生产及商业化Xpovio和eltanexor的权益,以及在澳大利亚和新西兰开发、生产及商业化KPT-9274和verdinexor的权益。其中,Xpovio治疗多发性骨髓瘤已获FDA加速批准上市。
国际药讯
1.诺华“first-in-class”哮喘组合疗法获欧盟CHMP支持。诺华公司复方产品Enerzair Breezhaler(QVM149,格隆溴铵/茚达特罗/糠酸莫米松))获欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐批准,用于治疗症状不受控制的哮喘患者。在一项Ⅲ期临床IRIDIUM中,与活性对照组(QMF149)相比,QVM149显著改善患者的肺功能,还改善患者的1秒用力呼气量。在第26周时,QVM149组在哮喘问卷评分(ACQ-7)方面显示了对哮喘控制的改善,但未能达到关键性次要终点。如果获批,这将是哮喘患者首次获得这三种药物组成的固定剂量复方产品。
2.PI3Kδ抑制剂联合CD20抗体Ⅲ期试验提前结束。TG Therapeutics创新口服PI3Kδ抑制剂umbralisib联合CD20抗体ublituximab,与ublituximab与obinutuzumab和苯丁酸氮芥联用相比,在治疗复发/难治性慢性淋巴细胞白血病(CLL)初治患者的Ⅲ期临床UNITY-CLL的中期分析中,达到了无进展生存期(PFS)的主要研究终点。经独立数据安全监查委员会(DSMB)的审查,建议提前结束该试验。详细数据将在医学会议上公布。该公司预计在年底递交监管申请。
3.再生元/赛诺菲PD-1治疗BCC临床结果积极。再生元和赛诺菲联合开发的PD-1抑制剂Libtayo,在治疗晚期基底细胞癌(BCC)的一项关键性临床研究中获积极顶线数据。在局部晚期患者中的客观缓解率(ORR)达29%(95% CI:19%-40%),85%产生缓解的患者缓解持续时间超过一年。持久性疾病控制率(DCR)为60%(95% CI:48%-70%)。在有转移性疾病的患者中,ORR达21%(95% CI:8%-41%),83%出现缓解的患者缓解持续时间超过一年。持久DCR为46%(95% CI:28%-66%)。再生元和赛诺菲计划今年递交监管申请。
4.INOVIO新冠肺炎DNA疫苗INO-4800临床进展。INOVIO公司新冠肺炎DNA疫苗INO-4800美国Ⅰ期试验完成受试者招募,共计40名健康志愿者接种了第一剂疫苗。该研究将接种两剂INO-4800,前后间隔四周。中期免疫反应和安全性评估结果预计于六月底公布。此外,INOVIO还与世界上一些领先的研究小组合作,对多个动物模型展开挑战性试验,并努力扩大INO-4800的生产。该公司计划年底前交付100万剂疫苗。
5.诺华/Incyte启动Jakafi第二项COVID-19 III期临床试验。诺华与Incyte宣布将启动JAK抑制剂Jakafi(ruxolitinib)针对COVID-19的第二项III期临床试验,评估Jakafi联合标准护理(SoC),在需要机械通气的急性呼吸窘迫综合征(ARDS)COVID-19患者中的安全性和有效性。4月上旬,这两家公司已启动了Jakafi联合SoC治疗COVID-19患者伴发细胞因子风暴的一项III期临床Ruxcovid试验。Jakafi是一种创新口服Janus激酶1和2(JAK1/JAK2)抑制剂,已获FDA批准用于治疗骨髓纤维化、真性红细胞增多症和急性移植物抗宿主病。
6.Vertex联手Affinia公司开发基因疗法。Vertex和Affinia公司将基于Affinia专有的腺相关病毒(AAV)载体文库AAVSmartLibrary和相关技术,共同开发治疗杜兴氏肌营养不良症(DMD)、1型强直性肌营养不良(DM1)和囊性纤维化(CF)患者的基因疗法。根据协议,Affinia将负责为DMD、DM1和CF等疾病领域的基因疗法开发新型AAV衣壳;Affinia将有资格获得高达16亿美元的前期付款和潜在的开发、监管和商业里程碑付款,以及产品的销售额分成;Vertex将负责并资助设计和开发基因疗法,包括选定衣壳、临床前和临床开发,以及商业化推广工作。
7.生物医药公司Alexion收购Portola公司。Alexion公司将以14亿美元收购Portola公司,以及Portola公司的已获批药物Andexxa。Andexxa是目前唯一一个获批的凝血因子Xa抑制剂逆转剂,能够快速逆转因子Xa抑制剂rivaroxaban和apixaban的抗凝血作用,控制严重和不可控制的出血。此外,Portola公司还有一款拟用于治疗血液癌症的在研SYK/JAK抑制剂cerdulatinib。Alexion公司是一家全球性生物医药公司,主要产品为两款补体抑制剂Soliris和Ultomiris。此次收购将扩展Alexion的产品管线,使其更为多元化。
医药热点
1.湖北将新冠病毒核酸和抗体检测纳入医保。5月5日,湖北省医保局发布通知,将新型冠状病毒核酸检测、新型冠状病毒抗体检测项目临时纳入基本医疗保险诊疗目录,按乙类支付,自5月6日起在全省执行。据了解,核酸、抗体检测项目纳入医保支付,医保支付具体标准由湖北省各地根据本地实际自行确定,但不得高于此前全省核酸检测180元/次、抗体检测50元/项的最高限价,实行动态调整。
2.CNN称新冠病毒去年底已在全球传播。据美国有线电视新闻网(CNN)报道,发表在《分子流行病学和传染病进化遗传学》杂志上的一份最新研究报告显示,新冠病毒自去年年底以来就已经在人群中传播了。据了解,英国科学家从全球共享数据库中提取了病毒基因序列,分析在不同时间、不同地点采集的来自世界各地的7600多例患者的样本。研究结果显示,新冠病毒首次感染人类的时间是去年年底。CNN称,这说明该病毒早在官方报告之前就已在西方传播。
股市资讯
【力生制药】公司药品碳酸氢钠片通过仿制药一致性评价。适应症为缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸。
【药明康德】公司2018年限制性股票与股票期权激励计划首次授予限制性股票第一个解除限售期解除限售条件成就,本次解除限售数量为330.90万股,本次解除限售的股票上市流通时间2020年5月12日。
【复星医药】高级副总裁Hequn Yin辞职。
1. CDE最新受理情况(05月06日)
审评动向
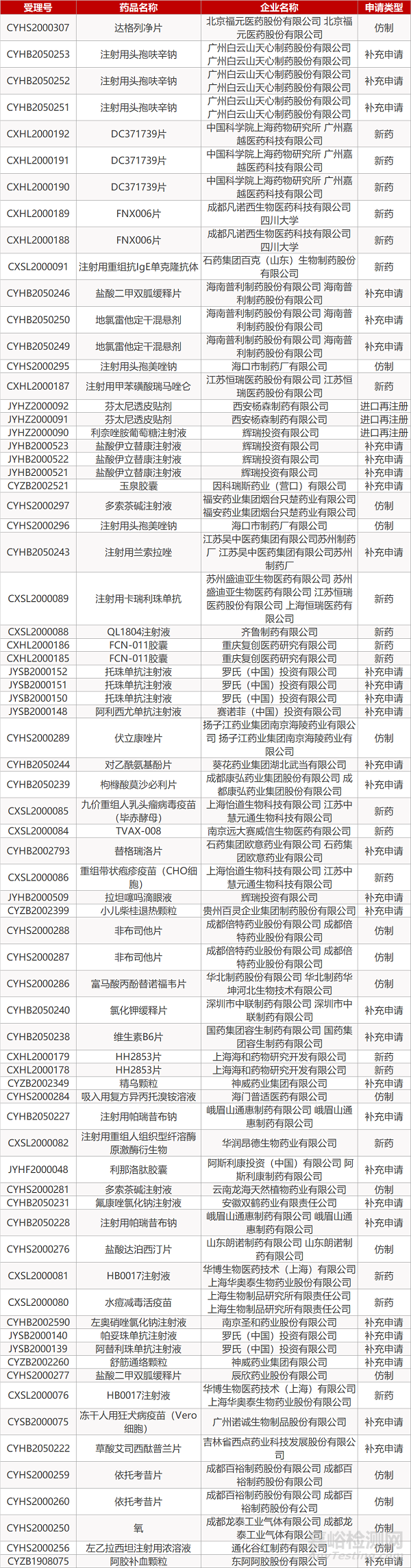
2. FDA最新获批情况(北美05月05日)
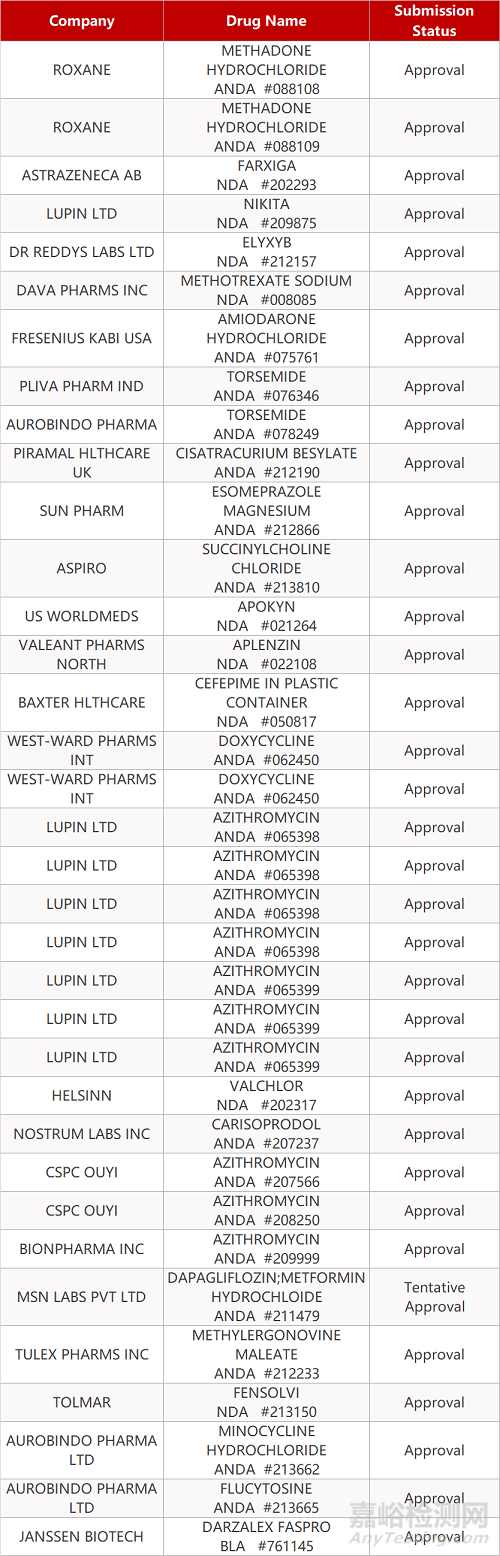
- The End -

来源:药研发


