您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-09-07 23:24
近日,USP发布了《微生物实验室良好规范》草案,该文件包含培养基制备(如使用纯化水、准确称量、避免过热)、储存运输、质量控制,以及培养时间、培养温度偏差处理、微生物分离传代、实验室布局、人员资质等内容,具体如下:
Media Preparation
培养基的制备
Media Transport and Storage
培养基的运输与储存
不应将含有琼脂的培养基平板储存在 0℃或以下,因为冷冻可能会损坏凝胶结构。
应保护培养基免受光照、过高温度和温度变化的影响,这些因素可能导致冷凝。
应考虑将琼脂平板储存在密封包装或容器中,以防止平板水分流失。
Quality Control and Receipt Testing
培养基的质量控制与来货检测
应对制备的所有批次的培养基以及商业供应商的每一批培养基进行质量控制测试。减少测试的正当理由应包括对供应商审计、供应商GMP控制和系统的充分性、拒收率和投诉以及运输合格性的考虑。
成品培养基应在充分照明的条件下通过对平板和试管的目视检查来检查以下质量和完整性参数:
Damaged primary containers or lids
主容器或盖子损坏
Unequal filling of containers
容器灌装量不均
Dehydration resulting in cracks or dimpled surfaces on solid media
脱水导致固体培养基出现裂缝或凹面
Hemolysis
溶血
Excessive darkening or color change
过度变暗或颜色变化
Crystal formation from possible freezing
可能因冷冻形成结晶
Excessive number of bubbles within a critical area
关键区域内气泡过多
Status of redox indicators (if appropriate)
氧化还原指示剂的状态(如适用)
Lot number and expiration date
批号和失效日期
Sterility
无菌性
Absence of foreign material and microbial growth or contamination
无外来物质和微生物生长或污染
Absence of media or other material on the exterior of containers or lids
容器或盖子外部无培养基或其他物质
A raised agar level for surface contact plates should be verified
应确认接触皿的琼脂面是否凸起
Table 1. Growth Promotion and Acceptance Criteria
表1.促生长及可接受标准
促生长测试失败不得用于否定阳性测试结果。
Buffers and Reagents
缓冲液和试剂
所有缓冲液和试剂在使用前都应进行进厂质量确认。
MICROBIOLOGICAL MEDIA INCUBATION TIMES
微生物培养基培养时间
培养持续时间小于 3 天的微生物检测,其培养时间应以小时表示:例如,“在 30°–35° 下培养 18–72 小时”。培养时间超过 72 小时的检测,培养时间应以天表示:例如,“在 30°–35° 下培养 3–5 天”。对于以天表示培养时间的检测,上午或下午开始的培养通常应分别在当天上午或下午的同一时间结束。
INCUBATION TEMPERATURE EXCURSIONS
培养温度偏差
LABORATORY EQUIPMENT
实验室设备
大多数设备(培养箱、高压灭菌器等)都需进行安装确认、运行确认和性能确认。此外,通常需要定期校准(一般为每年一次,或根据风险评估确定频率)。
应定期清洁和消毒培养箱、冰箱、水浴等设备,以尽量降低实验室的污染可能性。应清洁培养箱和冰箱的门封条,并检查其维修状况。这些工作应纳入设备预防性维护计划。难以消毒的设备(如冰箱和培养箱)应与无菌操作(如测试用培养基的储存、无菌测试样品的培养)和活菌培养操作隔离开,以尽量降低测试意外污染的可能性。
LABORATORY LAYOUT AND OPERATIONS
实验室布局和操作
实验室的布局和设计应仔细考量微生物实验室良好操作规范和实验室安全的要求。应尽可能最大限度地减少微生物培养物或用于聚合酶链反应(PCR)测试的 DNA/RNA 样品的交叉污染,且在极不可能发生污染的环境中处理微生物样品也很重要。
一般而言,实验室应分为洁净区 / 无菌区和活菌培养区。若可能,处理和培养环境及其他微生物测试样品的区域应完全不含有活菌培养物。
一些样品会显示出微生物生长,需要进一步的实验室分析来鉴定污染物。当检测到生长时,应将样品从实验室的清洁区尽快转移至活菌培养区。传代培养、染色、微生物鉴定或其他研究操作应在实验室的活菌培养区进行。若可能,任何被发现含有生长菌落的样品都不应在实验室的洁净区打开。仔细隔离受污染的样品和材料将减少假阳性结果。
从事取样活动的人员不应进入实验室的活菌培养处理区或在其中工作。理想情况下,被分配进行取样活动的人员(尤其是支持无菌加工的人员)不应在活菌培养实验室操作附近工作。
SAMPLE HANDLING
样品处理
进行微生物测试取样时应使用无菌技术,以尽量降低假阳性的风险。
尽量缩短取样与测试之间的时间并控制储存条件非常重要。
微生物样品在测试前不应冷冻储存,因为这种做法可能导致微生物存活力丧失,进而影响结果的有效性。
若样品要运输到远处进行测试,那么运输条件(时间、温度等)应适当(例如,冷藏;必要时,应确认其适合该测试和样品)。例如,生物负荷样品从取样时间到分析开始时间,可在 2°–8° 下保存长达 24 小时(3);然而,当无法在 24 小时内进行测试时(例如,使用合同实验室时),取样与测试之间的实际最长保存时间应得到实验研究(如挑战试验)的支持。
COMPETENCIES AND TRAINING OF PERSONNEL
人员的资质和培训
文件规定,操作人员、主管和管理人员的核心教育背景应在微生物学或密切相关的生物科学领域。并指出,微生物学是一门基于科学的学科,其涉及的生物学原理与分析化学和工程学科的原理存在显著差异。很多时候,未接受过特定微生物学培训的人员很难实现这种转变。
CONSIDERATIONS FOR INVESTIGATIONS AND MICROBIOLOGICAL RISK ASSESSMENTS
调查与微生物风险评估的考虑因素
当观察到不符合药典专著或其他既定可接受标准的结果时,需要进行调查。关于调查,应考虑到微生物在样品或产品中不一定是均匀分布的;微生物数量在储存后会发生变化;在某些情况下,测试时会使用样品的全部的量;且取样只能代表取样当时的状态;化学分析的经典复检规则不应应用于微生物检测。然而,对原始产品、原辅料、中间体、环境等的额外测试可用于为根本原因调查提供支持性信息,但不能用于否定原始结果。可制定微生物风险评估以协助调查。
为了制定有用的微生物风险评估,应纳入在相关主题和微生物学方面有经验的人员。需要注意的是,风险评估并不能解决任何质量问题。
LABORATORY RESOURCES
实验室资源
Oversight of Suppliers
供应商的监管
METHOD TRANSFER
方法转移
ENUMERATIVE MICROBIOLOGY
微生物计数
当固体培养基的整个表面被微生物生长覆盖(融合生长)时,准确计数不可行,结果可记录为≥1 CFU。琼脂平板法的检测限为 1 CFU,超过可计数范围上限的 CFU 计数被称为 “难以计数(TNTC)”。这并非意味着 CFU 无法被计数,而是数量超过了可回收数量,且最准确地说,超过了实际存在的数量。
Second Person Verification
第二人确认
关键测试的菌落计数(如非无菌成品药的微生物计数测试的最终读数)应纳入第二人确认。为确保计数准确,建议对菌落计数进行定期抽查。
文件规定,平均菌落计数在转换为对数表示法和后续比较之前,不得四舍五入。这种 “计算中途” 的四舍五入可能导致错误结论。
DATA INTEGRITY OF MICROBIOLOGICAL DATA
微生物数据的数据完整性
文件还提及微生物检测过程中的数据完整性问题。
INTERPRETATION OF ASSAY RESULTS
测定结果的解释
文件指出,微生物数据通常不是正态分布的,可能包含许多零计数(对于高度受控或无菌区域),并且变异性很大。因此,基于正态分布数据的经典过程控制工具可能不适用。使用负二项分布或伽马分布的百分位排序方法已被证明是可靠的,并且涵盖了大量不同的微生物数据。如果有足够的数值,也可以使用非参数拟合作为替代方法。
文件说明了最常用于培养基制备的水是纯化水,但在某些情况下,使用去离子水或蒸馏水可能是合适的。质量较差的水不得用于微生物培养基的制备。
培养基的灭菌应在制造商提供的参数范围内进行,或由用户验证。湿热高压灭菌是首选的灭菌技术,但在热敏成分发生降解的情况下除外。过滤灭菌对某些配方也可能是合适的。
应测试每一批次成品培养基的 pH 值。如检查冷藏的外购培养基的 pH 值,应使其恢复至环境室温。对于琼脂表面,建议使用平面 pH 探头;对于液体,建议使用浸入式探头。培养基的 pH 值应在制造商指示值的 ±0.2 范围内。对于实验室自制培养基,除非规定在灭菌过程前确认培养基的 pH 值,否则每一批培养基的 pH 值应在冷却至室温(20°–25℃)后,通过无菌抽取样品进行测试来确认。
每一批次成品培养基和实验室自制的培养基在使用前都应使用一组经过科学论证和指定的参考微生物进行促生长测试。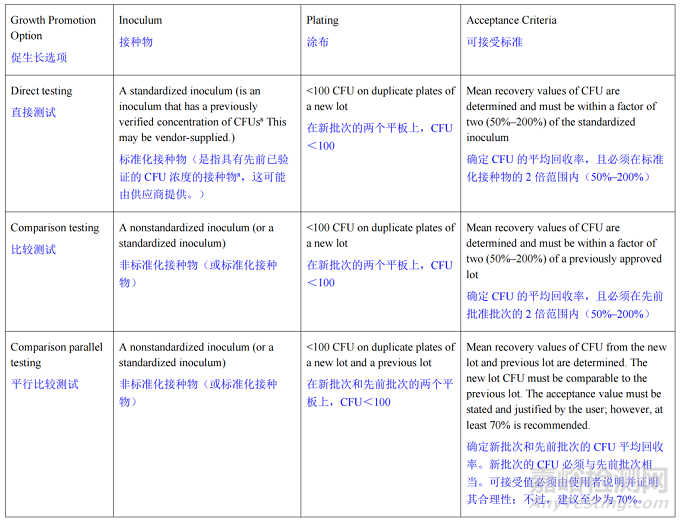
培养基的有效期应具有支持性的促生长测试,以表明培养基的性能在失效日期(包括失效日期)之前仍符合可接受标准。
当一批培养基不符合促生长测试的要求时,应启动调查以确定原因。该调查应包括一个纠正行动计划,以防止问题再次发生。任何未通过促生长测试的培养基批次都不适合使用。
若规定的培养时间和温度不符合程序要求,应开展书面的调查,以确定对测试样品的潜在影响,以及应采取何种措施(如有)和样品的处置方式。
实验室性能的一个衡量指标是实验室对所开展检测进行调查的数量,但仅这一指标是不够的。除了跟踪调查情况外,还应跟踪从样品提交到开始检测的时间,以及从检测结束到报告发布(或检测结束)的时间。这些方面出现显著延迟也表明实验室人员配备不足。
供应商提供的物料的微生物质量会对实验室(例如培养基、试剂、培养物)或生产(例如辅料、组件)产生重大影响;因此,微生物学知识和经验对于充分监管供应商至关重要。
文件还介绍了微生物分析方法转移方面的内容,包含对比试验和豁免策略。
来源:GMP办公室


