您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-04-22 10:04
前言
4月15日欧盟委员会出台了一份新冠病毒检测试剂盒要求的指南文件,今天我就将其中的要点和大家作个介绍。
第一点是是这份文件出台的背景。文件首先提了检测试剂盒在抗击疫情方面的重要性,紧接着也提到了确保试剂盒能够达到宣称的性能指标的重要性。
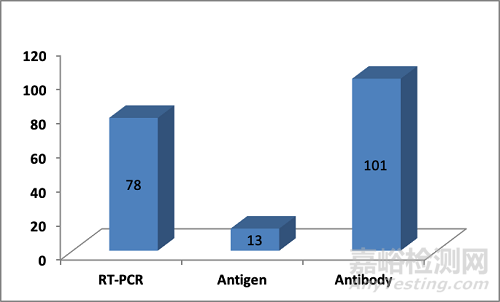
第二点是截至到2020年4月初,大约已经有78家的RT-PCR试剂盒,13家抗原快速检测试剂盒,101家抗体检测试剂盒(大多数是快检)有拿到基于98/79/EC的CE认证(在98/79/EC的法规中新冠病毒检测试剂盒是属于自我声明的产品)。
第三点是截至到目前为止欧盟委员会已经实施的一些举措。包括:
在MDCG框架下继续保持成员国监管机构之间关于体外诊断试剂的信息沟通。包括: 体外诊断试剂的合规性,可获得性和可靠性,维护体外诊断试剂厂商的名录并在各成员国进行分享,各成员国的特殊政策以及制定特殊政策的原因。
和业界保持沟通,了解体外诊断试剂的可获得性和性能。
定期和WHO就针对COVID-19的相关举措进行沟通。
在体外诊断试剂打假工作上和其它部门开展合作
颁布医疗器械和体外诊断试剂符合性评估的指南文件(https://ec.europa.eu/docsroom/documents/40607)和与疫情防控产品相关的国际认可标准的清单(https://ec.europa.eu/docsroom/documents/40606)
产出体外诊断试剂关于器械性能文献评审和性能要求的初步指南文件,涵盖的试剂包括RT-PCR, 抗原和抗体检测。该文件要在欧盟委员会,欧洲疾病预防控制中心,成员国监管机构的专家和健康技术评估单位的合作下完成。(如果我没有猜错的话就是指这份文件)
开发出用于RT-PCR质量评估的阳性控制参考品并供给欧盟范围内的实验室使用。
支持研发和创新,协调欧洲范围内和全球的研发工作的开展。有几个是COVID-19试剂盒开发,疫苗研发和治疗相关的项目已经开始。还有其它的项目也会陆续开始。
第四点是敲黑板的,也是广大体外诊断试剂厂商要特别关注的,就是欧盟接下来还有哪些举措。
接下来欧盟委员会会在接下来的几周讨论国家检测策略。该策略会考虑每种体外诊断试剂的预期用途以及在哪种情况下使用,尤其是特定的人群信息和用于疾病发展的什么阶段。性能指标方面主要要考虑诊断敏感性,诊断特异性和检测限。
接下来几个月,欧盟委员会,成员国和相关方,在欧洲疾病预防和控制中心建议下将在符合性评价框架下讨论各种新冠病毒检测试剂盒的性能评价要求并定期审核,在适当的时机下会由MDCG出台相关的指南文件。
欧盟委员会将和各成员国紧密合作确保安全和可靠的试剂上市。欧盟委员会将会和业界、成员国监管机构讨论看后续是否需要出台一致性评估的指南文件。欧盟委员会将通过有效分享信息的方式协助各个成员国开展市场监督工作。
对于假冒伪劣的试剂的打击继续保持高压态势,假冒伪劣的情况主要包括:假的注册证书,假的公告机构的认证证书,要求要提供的法规文件缺失。
在欧盟疾病预防和控制中心的建议下,欧盟委员会将和各成员国合作,在欧盟范围内建立COVID-19的参考实验室的网络,进行实验室间的信息交流,包括信息交流,实验室需求识别,控制样品的管理和运送等等。
欧盟委员会将和各成员国合作建立试剂性能评估的方法(比如参考物质和标准化的比较方法)并确保该方法在欧盟范围内保持一致。
总结一下,在IVDD法规框架下,新冠病毒检测试剂盒的上市要求是自我声明,欧盟委员会也意识到了这个弊端,也一直在通过出台更多的要求的方式努力补救。已经进场和后续进场的新冠病毒检测试剂盒厂商都将面临这些挑战。

来源:启升资讯


