您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-03-02 14:08
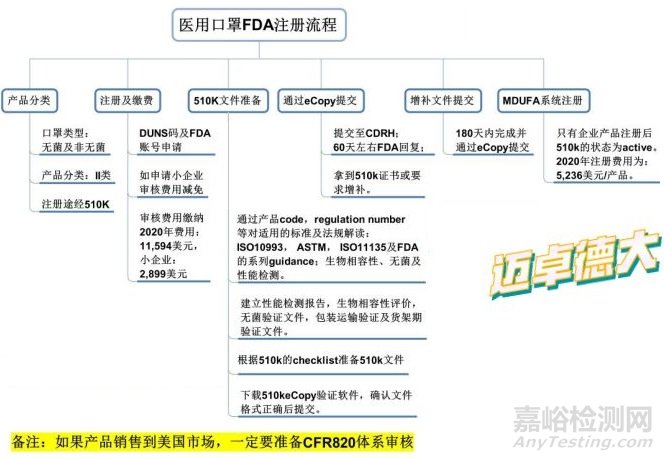
医用口罩出口美国的FDA注册流程
FDA医用口罩分为两类:无菌、非无菌
FDA注册流程如下:
1、DUNS码及FDA账号申请(2周时间)
2、如果申请小企业审核费用减免,下载Form3602A到税务机关填写盖章后邮寄至FDA,60天内答复。
3、审核费用缴纳。
4、510k文件准备
5、通过产品的code,regulation number等对产品所适用的标准及法规进行解读:ISO10993,ASTM, ISO11135及FDA的系列guidance:生物相容性,无菌及性能检测。
建立性能检测报告,生物相容性评价,无菌验证文件,包装运输验证及货架期验证文件。
6、根据510k 的checklist准备510k全套文件
下载510keCopy验证软件,确认文件格式正确后提交。
510K文件通过eCopy提交至CDRH60天左右FDA回复。拿到510k证书或要求增补。
增补文件在180天内完成并eCopy提交。
如果产品销售到美国市场,一定要准备CFR820体系审核。
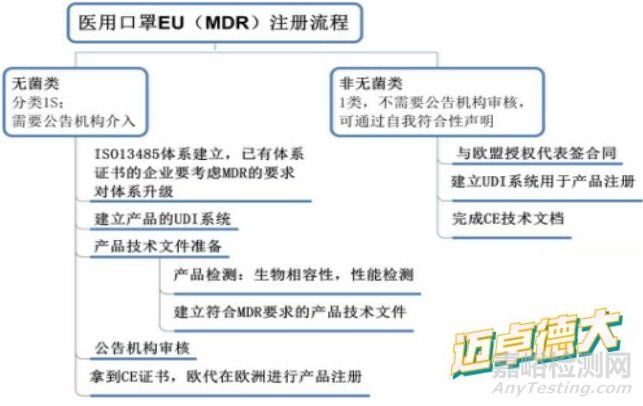
医用口罩出口欧盟的CE(MDR)注册流程
1、无菌类:分类1S,需要公告机构介入。
2、ISO13485体系建立,已有体系证书的企业要考虑MDR的要求对体系升级。
3、建立产品的UDI系统,准备产品的技术文件
4、产品要进行生物相容性,性能检测检测;详见医用口罩出口需要做哪些检测认证?
5、建立符合MDR要求的产品技术文件,公告机构进行审核。
6、拿到CE证书,欧代在欧洲进行产品注册
非无菌类,不需要公告机构审核,企业可通过自我符合性声明途径进行产品注册,但注册前要完成:
1)要与欧盟授权代表签合同;
2)建立UDI系统用于产品注册。
3)最后要完成CE技术文档

来源:迈卓德大医械整理


