您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-19 08:57
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
今日头条
辉瑞恩杂鲁胺获FDA扩展适应症。FDA批准辉瑞/安斯泰来特异性雄激素受体抑制剂Xtandi(恩杂鲁胺,enzalutamide)扩展适应症,治疗转移性激素敏感性前列腺癌(mHSPC)患者。这一批准,让Xtandi成为首款获FDA批准可治疗三种不同形态晚期前列腺癌(非转移性和转移性去势抵抗性前列腺癌,和转移性去势敏感性前列腺癌)的口服疗法。一项Ⅲ期临床ARCHES结果表明,与安慰剂和雄激素剥夺疗法(ADT)联用相比,Xtandi与ADT联用将患者出现放射学进展或死亡的风险降低61%(HR=0.39, 95% CI:0.30-0.50,p<0.0001)。同时,Xtandi+ADT治疗组中更多患者的前列腺特异性抗原(PSA)降低到无法检测到的水平(p<0.001)。
国内药讯
1.恒瑞甲苯磺酸瑞马唑仑即将获批上市。恒瑞医药1类新药注射用甲苯磺酸瑞马唑仑的审评状态变更为“在审批”,预计即将于近日获批。瑞马唑仑是一种短效的GABAa受体激动剂,用于手术中的全身麻醉。麻醉领域也一直是恒瑞三大主线之一,目前恒瑞已经有右美托嘧啶、七氟烷、苯磺顺阿曲库铵等多个麻醉领域大品种。恒瑞的这三大品种销售额估计近50亿元,市占率都是50%以上(右美托嘧啶的市占率是88%)。据米内网数据,中国公立医疗机构化学药终端麻醉剂2018年实现销售额141.51亿元,同比增长12.4%。
2.正大天晴硼替佐米新增规格获批。正大天晴抗肿瘤药注射用硼替佐米获国家药监局批准,增加若干药品规格(包括增加 1.0mg 规格)。硼替佐米是新型靶向抗癌药,主要用于治疗多发性骨髓瘤及被套细胞淋巴瘤。据米内网数据显示,2018年在中国公立医疗机构终端硼替佐米注射剂销售额超过13亿元,同比增长55.38%。在品牌格局中,原研药西安杨森占据超过85%的市场份额,销售额近12亿元。截至目前,该品种国内获批的生产厂家有豪森药业、正大天晴、齐鲁制药等5家企业。
3.美大康华康药业盐酸氨溴索即将获批。四川美大康华康药业4类仿制药盐酸氨溴索注射液的上市申请审评审批状态变更为“审批完毕-待制证”,如果获批,将视同通过一致性评价。盐酸氨溴索是由勃林格殷格翰原研的黏痰溶解剂,临床上适用于伴有痰液分泌不正常及排痰功能不良的急性、慢性呼吸系统疾病。盐酸氨溴索是临床上常用的祛痰药,有注射剂、口服溶液剂、片剂、分散片剂、胶囊剂等,其中注射剂占总体市场比重为85.23%。2018年中国公立医疗机构终端盐酸氨溴索注射剂合计销售额为61.06亿元,其中盐酸氨溴索注射液占据58.9%的市场份额。
4.艾力斯艾氟替尼上市申请拟纳入优先审评。艾力斯医药的甲磺酸艾氟替尼片上市申请拟纳入优先审评公示名单。甲磺酸艾氟替尼是一款不可逆、第三代EGFR抑制剂。ESMO2019大会上公布的艾氟替尼I/II期研究结果显示,在130例EGFR-TKI治疗后进展的局部晚期或转移性 T790M突变阳性的非小细胞肺癌(NSCLC)患者中,所有接受艾氟替尼治疗的患者ORR达到76.7%,DCR达到82.8%。其中,中枢神经系统转移患者的ORR达到58.8%。安全性方面,发生治疗相关不良事件(TRAE)的概率为95%。
5.诺华3款抗癌药物的7项临床在华获批。诺华旗下CDK4/6抑制剂LEE011、SHP2抑制剂TN0155以及PD-1抑制剂PDR001的7项临床申请获国家药监局临床试验默示许可。获批的临床研究包括LEE011与TN0155的联合疗法治疗晚期恶性肿瘤、TN0155与LEE011联合或与PDR001联合用于特定晚期恶性肿瘤、以及PDR001单药治疗晚期恶性肿瘤等。LEE011已于2017年获FDA批准(商品名为Kisqali),与芳香酶抑制剂联合作为初始内分泌类治疗方案,用于绝经后HR+/HER2-的晚期或转移性乳腺癌女性患者。TN0155是一款在研SHP2抑制剂,目前它在临床试验中,与Mirati 公司的MRTX849联用,治疗携带KRAS G12C 突变的癌症患者。
国际药讯
1.PharmaMar抗肿瘤药物递交新药申请。PharmaMar公司开发的抗肿瘤化合物lurbinectedin已向FDA递交新药申请,治疗经过铂基化疗治疗后疾病进展的小细胞肺癌(SCLC)患者。一项Ⅱ期临床结果显示,lurbinectedin单药治疗可使经治的SCLC患者达到35.2%的客观缓解率(ORR)和68.6%的疾病控制率(DCR)。患者中位缓解持续时间达到5.3个月。在8例曾经接受过癌症免疫疗法治疗的患者中,5例产生响应。
2.GSK突破性ADC药物骨髓瘤II期研究结果积极。GSK公司抗体偶联药物belantamab mafodotin(GSK2857916)在治疗复发难治多发性骨髓瘤(MM)的II期DREAMM-2研究中获积极结果。试验结果显示,注射给予belantamab mafodotin 2.5mg/kg的患者可以产生31%(30/97)的客观应答率,18.6%(18/97)的患者是非常好的部分应答(VGPR),3%(3/97)是完全应答。在随访6个月时,产生应答患者的中位应答持续时间仍未成熟。详细结果发表在《Lancet Oncology》杂志上。目前该新药已向FDA提交了上市申请。
3.BioMarin公司C型利钠肽类似物III期研究成功。BioMarin公司公布其C型利钠肽类似物vosoritide(伏索利肽,BMN111)治疗软骨发育不全症儿童患者全球III期研究的最终阳性结果。52周的治疗结果显示,研究达到主要终点。经安慰剂校正,vosoritide治疗的生长速度相对基线的变化为1.6厘米/年(p<0.0001)。该结果与所研究的广大患者群体中的结果一致。研究中vosoritide的一般耐受性良好,无临床上显著的血压下降。BioMarin公司计划明年上半年提交上市申请。
4.Alnylam创新RNAi疗法达到Ⅲ期终点。Alnylam公司在研RNAi疗法lumasiran,在治疗1型原发性高草酸尿症(PH1)患者的Ⅲ期试验ILLUMINATE-A中,达到主要终点和所有次要终点。与安慰剂相比,接受lumasiran治疗的患者尿液中草酸盐的平均水平较基线时显著降低。完整结果将在2020年3月的OxalEurope国际会议上公布。Alnylam计划明年年初向FDA和欧盟EMA递交其监管申请。Lumasiran靶向编码肝脏中乙醇酸氧化酶( GO)的HAO1基因的mRNA,此前已获FDA授予的孤儿药资格和突破性疗法认定,以及EMA授予的PRIME药品认定。
5.Biohaven偏头痛治疗药物达Ⅱ/Ⅲ期临床主要终点。Biohaven鼻内给药的CGRP受体小分子拮抗剂vazegepant,在治疗急性偏头痛的关键性Ⅱ/Ⅲ期研究中达主要终点。与安慰剂组相比,10 mg和20 mg Vazegepant治疗组在2小时内达到头痛缓解和无偏头痛相关严重症状发生的患者比例具有统计学意义的显著优势。其中,达到头痛缓解的患者比例分别为22.5%和23.1%,而对照组中的这一数值为15.5%。此外,vazegepant在表明早期活性的多个次要终点上也有很好的表现。详细结果将在2020年的医学会议上发布。
医药热点
1.《自然》杂志公布年度十佳论文。英国《自然》杂志网站公布2019年十大杰出论文,生物医学相关领域的论文占据半数席位。在本次入选的论文中,中国研究占到两席,复旦大学对亨廷顿舞蹈病的新疗法与中科院上海有机化学研究所制成的点击化合物库入选。亨廷顿病由异常的亨廷顿蛋白(mHTT)引起。复旦大学鲁伯埙教授、丁滪教授和费义艳研究员领衔的一支多学科团队,利用细胞内的天然清除机制——自噬作用,由“自噬小体”有选择地降解mHTT蛋白。三个物种的亨廷顿病模型显示,这项研究得到的四种化合物可以产生功能改善,为临床治疗带来曙光。
2.日本2019年蜱虫传染病感染人数达百人。日本国立感染症研究所17日发布消息称,日本2019年蜱虫传染病感染者达百人,创历史新高。该病发病地区以日本九州地区和西日本地区为主。由蜱虫叮咬导致的高致死率传染病名为“发热伴血小板减少综合征”,感染者会出现发烧、全身乏力、腹泻、腹痛等症状,严重会导致死亡。目前日本并无疫苗及有效的治疗药,由于传播该病的蜱虫大多生活在野外,专家呼吁在进入森林、草丛时应该减少皮肤暴露。
3.江西启动医师定期考核。2018~2019年度江西省医师定期考核工作启动,考核内容包括工作成绩评定、职业道德评定和业务水平测试。江西省卫健委医政医管处相关负责人表示,通过医师定期考核,要把不符合职业道德标准、达不到基本知识技能要求的人清除出医师队伍,建立健全医师退出机制。根据要求,对考核不合格的医师,将责令其暂停执业活动3个月~6个月,并接受培训和继续医学教育。暂停执业活动期满,再次进行考核,对考核合格的,允许其继续执业;对考核不合格的,将注销注册,收回医师执业证书。
股市资讯
【华海药业】公司缬沙坦原料药恢复欧洲药典适应性(CEP)证书,缬沙坦原料药将获准恢复出口欧盟的资格。
【健民集团】(1)拟以自有资金投资500万元设立全资子公司海南晴川健康科技有限公司。(2)全资子公司叶开泰国药分别与南京恒道医药科技有限公司、北京阜康仁生物制药科技有限公司签订《技术委托开发合同》,分别委托其进行JMEY001药品、JMEY002药品技术开发。
审评动向
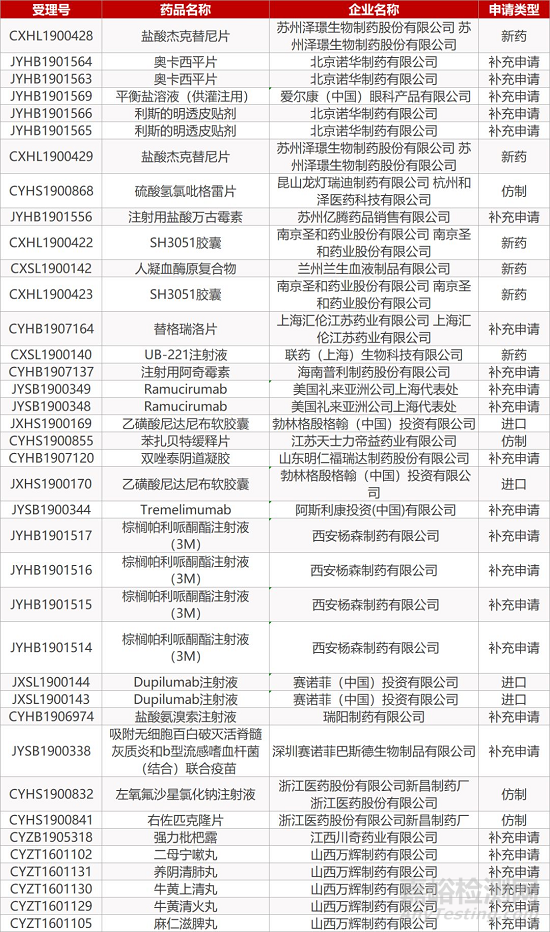
1. CDE最新受理情况(12月18日)
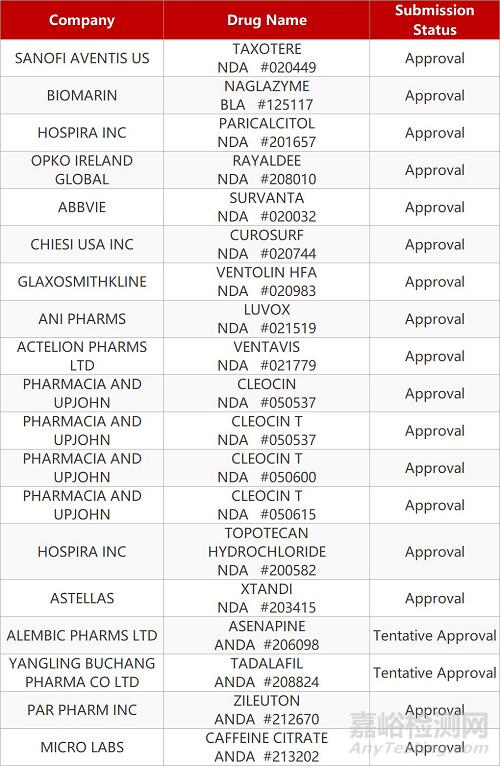
2. FDA最新获批情况(北美12月17日)

来源:药研发


