您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-05-22 11:28
ISO 10993-1 2018在今年八月出台,一时间成为了厂商热议的焦点。与旧版标准相比,不管从页数、范围还是内容来看,新版标准都发生了较大改变,给厂商也带来了不小影响。但是,小编在与厂商接触的过程中,发现大家对生物学评估和测试项目并不是很清楚,特别是涉及新旧版本的差异。所以,小编今天想以此为切入点,带领大家梳理基本概念,后续再用系列篇幅厘清测试项目的相关要求。
ISO 10993-1 2018由ISO/TC 194(医疗器械生物和临床评价技术委员会)于2018年8月修订发布,与ISO 10993-1:2009相比,新版标准由原来的21页扩充至41页,内容增幅较大,特别是在范围、术语和定义、器械分类以及测试项目方面,新增内容较多。那么,为什么新版标准会发生这么大变化呢?
近些年,医疗器械行业迅猛发展的势头,大家有目共睹。在09版颁布至今的9年时间内,与生物学评估和测试相关的新概念、新技术更是不断涌现,比如毒性阈值等新定义、新型的可吸收材料、新的药械组合等等。所以,ISO 10993-1作为行业内认可度极高、应用范围极广的参考标准,也必须顺应时代发展的潮流,进行大幅修订,以满足医疗器械行业需求。
明确标准的适用范围,可以作为大家了解新标准的第一步。本标准适用于:
在预期使用期内,与病人身体或使用者身体(如果该医疗器械是用于保护,如手术手套、面罩等)有直接或间接接触的材料和医疗器械的评估;
所有类型医疗器械的生物评估,包括有源、无源、可植入和非植入医疗器械;
为以下因素引起的生物危害提供了指导原则:a.如医疗器械随时间的变化等风险;b. 医疗器械或部件的破损使身体组织暴露在新材料中;
该标准不包括与细菌、霉菌有关的危害。
新标准中共列举了15个测试项目,与旧版标准相比,新增加的生物相容性试验项目包括:材料介导致热原性、慢毒性、致癌性、生殖发育毒性和可降解产物。
但由于医疗器械品类繁多,技术特点和性能参数都会存在很大差异,所以厂商应该根据自身产品特点选择适用的测试项目进行检测。接下来,我们一起梳理新标准中的15个测试项目:
细胞毒性 (Cytotoxicity):使用细胞培养技术测试细胞毒性,用于确定细胞死亡(例如细胞裂解)、细胞生长抑制、集落形成以及由医疗器械、材料或其提取物引起的对细胞的其他影响。如果进行测试,则应按照ISO 10993-5进行。
致敏性 (Sensitization):敏化测试可用于评估医疗器械、材料或其提取物的接触致敏性。如果进行测试,则应按照ISO 10993-10进行。
刺激性(包括皮内反应)(Irritation):刺激测试可用于评估医疗器械、材料或其提取物对应用部位的刺激性,如皮肤、眼睛和粘膜。试验应考虑接触部位及接触持续时间,并按照ISO 10993-10进行。皮内反应测试可用于评估组织对医疗器械提取物的局部反应。该试验适用于通过皮肤或粘膜试验确定刺激性不合适的情况(例如:植入或接触血液的医疗器械)。
血液相容性 (Haemocompatibility):血液相容性测试用于评估与血液接触的医疗器械或材料对血液或血液成分的影响。溶血是其中一种血液相容性测试,即评估红细胞溶解程度和血红蛋白释放。
材料介导的致热原性 (Material-mediated pyrogenicity):热原性测试用于检测医疗装置或材料的提取物介导的热原反应。但是,除了在含有生物衍生材料的医疗器械中观察到以外,材料介导的致热原性很少见。
急性全身毒性 (Acute systemic toxicity):在允许接触潜在的吸收有毒可浸出物和降解产物的情况下,可以在动物模型上进行急性全身毒性试验,评估24小时内单次或多次暴露在医疗器械、材料或其提取物的潜在危害。所进行的任何试验均应按照ISO 10993-11进行。
亚急性和亚慢性毒性 (Subacute and subchronic toxicity):亚急性和亚慢性毒性试验,用于评估单次或多次接触或暴露在医疗器械、材料或其提取物的毒性,持续时间不少于24小时,不超过测试动物总寿命的10%(例如:大鼠不超过13周)。如果进行,应按照ISO 10993-11进行。
慢性毒性 (Chronic toxicity):慢性毒性试验用于确定在试验动物的寿命期内,单次或多次暴露于医疗器械、材料或其提取物的毒性(例如:大鼠通常为6个月)。这些测试应按照ISO 10993-11进行。
植入效果 (Implantation effects):植入测试用于评估在预期使用部位或组织手术植入的材料或最终产品的局部病理学影响(比如:特殊牙科使用测试)。如果进行,应按照ISO 10993-6进行。
遗传毒性 (Genotoxicity):遗传毒性测试可用于评估基因突变的可能性、染色体结构和数量的变化,以及由医疗器械、材料或其提取物引起的其他DNA或基因毒性。如果进行测试,则应按照ISO 10993-3进行。
致癌性 (Carcinogenicity):ISO 10993-3讨论了在测试动物寿命期内评估医疗器械、材料或其提取物的致癌性的方案。致癌性信息可从毒性文献中获得。在没有任何显著致癌风险的情况下,致癌性试验很少被认为适用于医疗器械。
生殖和发育毒性 (Reproductive and developmental toxicity):ISO 10993-3中提到,生殖和发育毒性试验可用于评估医疗器械、材料或其提取物对生殖功能、胚胎发育(致畸性)以及产前和产后早期发育的潜在影响。只有当医疗器械对受试者的生殖潜力有潜在影响时,生殖毒性评估才能够开展。
降解产物 (Degradation):对于任何有可能在人体内降解的医疗器械、部件、组分或组织内残留的材料,都要提供降解信息。降解试验应考虑:1)医疗器械设计为可吸收;或2)成品医疗器械在与身体接触过程中可能会释放有毒的降解产物。应描述和记录影响降解速率和程度的参数。降解测试的框架在ISO 10993-9中给出。聚合物、陶瓷和金属的具体体外降解试验分别在ISO 10993-13、ISO 10993-14和ISO 10993-15中有具体描述。当颗粒降解产物以纳米材料的形式存在时,应根据ISO/TR 10993-22设计试验。
毒代动力学研究 (Toxicokinetic studies):毒代动力学研究的目的是评估医疗器械、材料或其提取物的可浸出物和降解产物的吸收、分布、代谢和消除过程(ADME)。在决定进行毒代动力学研究前,应考虑:1)医疗器械设计是否为可吸收;2)医疗器械是否为长期接触植入物;3)医疗器械在临床使用过程中是否会释放大量潜在的毒性物质、反应性降解产物和可浸出物进入体内;4)医疗器械是否会释放纳米物到身体中;5)药物和器械组合产品。
免疫毒理学 (Immunotoxicology):ISO/TS10993-20提供了免疫毒理学的概述,特别是医疗器械的潜在免疫毒性。应根据制造材料的化学性质来考虑免疫毒性试验。如果进行免疫毒性试验,则应按照ISO/TS 10993-20进行。
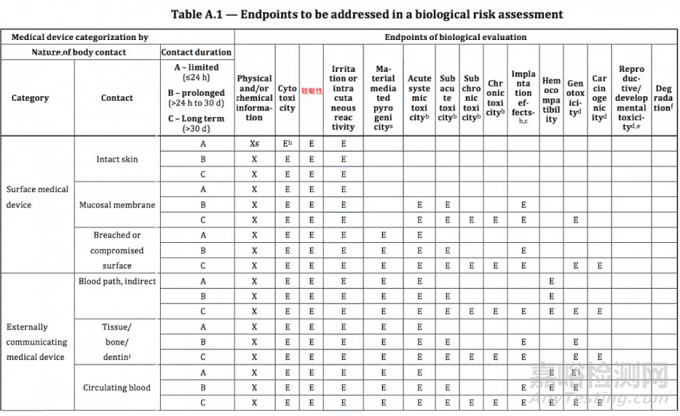
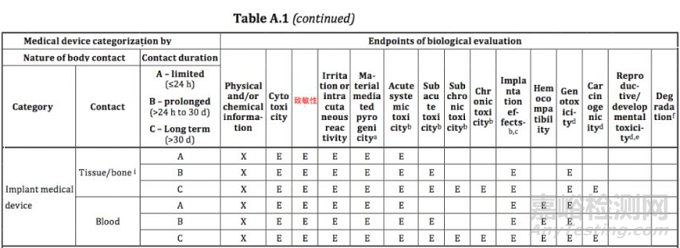
通过上述介绍,我们把新标准涉及的15个检测项目进行了简单梳理,相信大家对测试项目的基本概念有了一定了解。后续,小编将用系列篇幅,按照ISO 10993-1:2018 Annex A新版评估表的内容,和大家讨论测试工作的具体要求,敬请关注。

来源:启升资讯


