您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-05-17 15:56
摘要
基于代谢组学方法能较为直观和完整地呈现体外复杂体系中化学成分的轮廓差异及其在体内吸收、分布和代谢的差异。
代谢组学已经成为当今生物与医药领域的研究热点,其作为系统生物学的核心组学,与其他组学进行的系统性研究为中药作用机制研究提供了思路和方法[1]。代谢组学已经在临床疾病诊断及重大疾病的早期诊断等领域得到广泛应用。在代谢组学研究中最常采用的技术为核磁共振(NMR, nuclear magnetic resonance)[2]和质谱(MS, mass spectrometry)[3]分析技术。往往在实际应用中色谱分离技术,如气质(gas chromatography, GC)、液相(liquid chromatography, LC)和毛细管电泳(capillary elctrophoresis, CE),它们常与质谱串联起来分析。
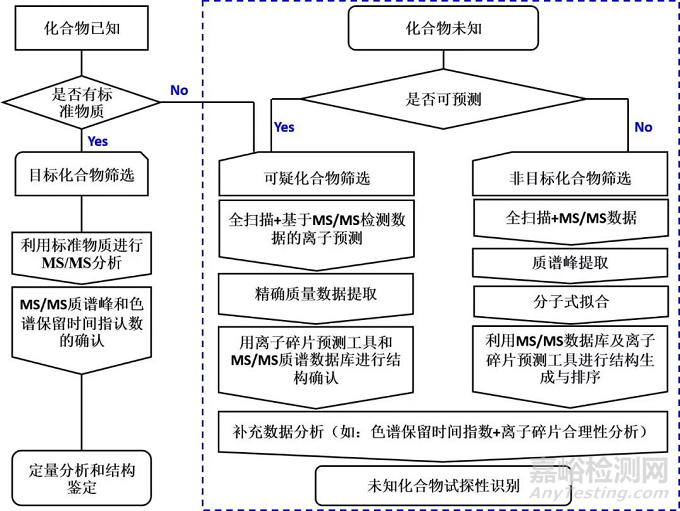
图1 三种分析方法策略流程图
基于气相色谱和液相色谱与高分辨质谱联用技术的分析策略主要有(图1):目标化合物分析方法(Target analysis)、非目标化合物分析方法(Un-target analysis)和可疑化合物分析方法(Suspect analysis)[4]。
利用非目标化合物分析方法筛选结果可以扩展和精炼目标化合物分析方法所研究的对象[5]。对于采集的数据包含的信息往往都比较庞杂,数据预处理过程和数据分析是至关重要的环节,这将直接影响到最终数据分析的结果。数据预处理过程中使用的软件大致分为商品化软件(如Markerlynx、MassHunter、AMDIS和ChromaTOF)和免费的软件(如Mzmine[6, 7],XCMS[8-10],MSFACTS[11]和MetAlign[12]等)两大类,它们可以将原始数据进行峰去卷积、标准化和峰对齐等处理。
紧接着,代谢组学中常采用的多元统计分析,能够对庞大的数据进行分析,发现样品之间或各组之间的异同[13]。无监督模式下的PCA和有监督模式下的OPLS-DA均是代谢组学分析常使用的一种分类方法[14, 15]。比如我们以中药黄芩为例,运用非靶向代谢组学手段结合Q exactive MS分析方法研究不同规格黄芩(枯芩和子芩)样品之间差异性的活性成分,研究思路如图2所示。
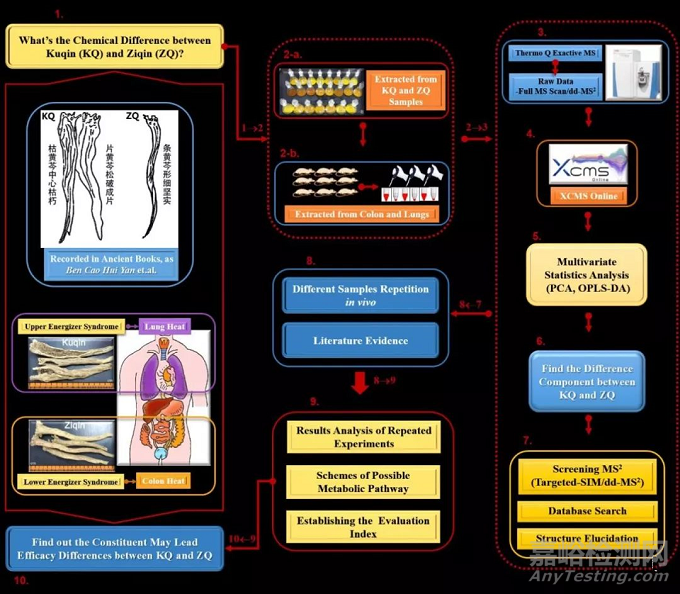
图2 基于代谢组学的研究方法应用于中药黄芩[16]
一、体外药材样品的制备
以中药材为例,样品的制备应根据样品自身的特性,优选最佳的提取方法(如超声提取、回流提取等)和溶剂。常用的提取溶剂为水、甲醇、乙醇、乙酸乙酯、氯仿等。
注意事项:前期样品制备方法可以采用单因素或正交实验进行条件优化;如果采用超声提取,应客观评判超声功率和超声时间引起水浴温度升高对提取样品的影响;应该充分评价提取样品所带来的操作误差对实验结果的影响。
二、生物样品的制备
生物样品主要包括体液(全血、血浆、血清、尿液、唾液和脑脊液等)、组织(脑、心、肝、脾、肺、肾、胸腺、胰腺、小肠、大肠、肌肉和骨骼等)以及其它(毛发和粪便等)样品。不同类型样品前处理方式有所不同。常见的生物样品前处理方法:包括蛋白沉淀(PP)、液液萃取(LLE)和固相萃取(SPE)法。
注意事项:应充分评价提取样品所带来的操作误差对实验结果的影响,有必要需设定质控样品;需考虑样品收集过程中稳定性问题,如尿液样品的收集,基质中酶、光照及温度对样品的影响;需考虑样品前处理过程中吸附性问题,如脑脊液(CSF)和尿液中因为蛋白含量较低,较易与样品收集管由于表面电荷产生相互吸附以及质控样品制备问题。
三、采集数据的预处理
目前,对于LC/GC-MS采集的数据进行预处理的软件非常之多,有免费开源的(如XCMS,MZmine和MetAlign等)、商业收费的(Markerlynx,MassHunter,ChromaTOF和ChemPattern 2.0等)和自主开发设计的编程软件(如Metlab)。每一种软件都有各自的优缺点,需要按照自己的目的或需求进行选择。其中,XCMS是一个免费的R软件包,可用于LC/MS或GC/MS数据处理,是目前使用最为广泛,引用文献最多的一个软件[17]。XCMS online)(图3)是基于云计算的在线版本(https://xcmsonline.scripps.edu/),不需要下载安装,允许用户在线上传LC/MS或GC/MS数据(格式如NetCDF,mzXML和mzData等),如按照自定义选项设置相关参数后,就可在线查看和分析结果[8-10, 18]。
对预处理后数据采用Excel的COUNTIF函数对原始数据进行筛选去除零,除零原则根据自身要求而定,常用80-20原则,即保留样品中含有20%以下为零的数据。然后进行多元统计分析(如PCA和OPLS-DA)得到VIP(≥1)值表,采用Excel的VLOOKUP函数对找到的VIP值≥1的数据和原始数据进行匹配,并列出每一个m/z下的原始数据信息,以便于甄选。

图3 XCMS Online软件界面
四、多元统计分析
代谢组学中运用的多元统计分析方法主要包括无监督分析(unsupervised analysis)方法(如PCA,HCA)和有监督分析(supervised analysis)方法(如PLS,PLS-DA,OPLS,和OPLS-DA)。无监督分析方法是指所有样品不加以区分,每个样品都对模型有着同样的贡献。对于组间差异较大,而组内差异较小时,无监督分析方法可以明显区分组间差异。反之,组间差异不明显,而组内差异较大,无监督模式就难以发现和区分组间差异。原因在于,无监督分析方法不能忽略组内误差,消除与研究目的无关的随机误差,过于关注于局部或细节,忽略对象的整体及其规律,因此,不利于发现组间差异和差异性化合物,而这正是代谢组学研究最重要的目的。
于是乎有监督分析方法这类新的分析技术应运而生,能够很好地解决上述存在的问题。原因是其先将检测样品进行分类区分,再进行分析,这样在计算时就忽略样品间组内随机差异,突出组间系统差异[13]。目前代谢组学研究评价中应用最为常用的模式识别方法主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),如图4所示。OPLS-DA为PLS-DA的改进方法,滤掉与类别判断不相关的变量信息,提高模型判别的准确性。采用的多元统计软件为SIMCA P。
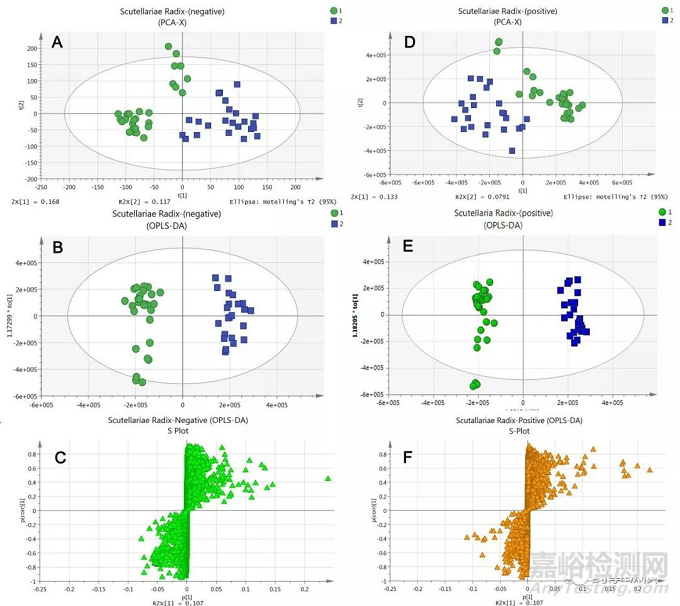
图4 典型的PCA(A和D)、OPLS-DA(B和E)和S-Plot(C和F)图[16]
OPLS-DA模型概述图中R2Y(cum)表示模型每次进行分类后对所有因变量Y变化进行说明部分;Q2(cum)表示可以通过模型的交叉验证进行预测因变量Y变化的部分。R2Y(cum)和Q2(cum)接近1.0说明模型建立完美。PCA和OPLS-DA模型下,我们常根据实际情况采用UV、Par和Ctr三种标度化类型(表1)。
表1 不同类型标度化(Scaling type)及其定义
|
标度化类型 |
定义 |
|
UV自标度化 |
基于每个变量各自的方差进行中值化和标度化 |
|
Par (Pareto)标度化 |
变量中值化但是未标度化 |
|
Ctr中值标度化 |
基于每个变量各自的标准差进行中值化和标度化 |
五、化学成分的解析
非靶标化合物分析方法基本流程为样品前处理的选择和优化、仪器分析(全扫描)、数据处理(预处理、多元统计分析)、目标化合物的二级图谱扫描、结构指认[5]。各厂家的高分辨质谱仪(HRMS)类型主要有Q-TOF,IT-TOF和Orbitrap等系列。其中,如Q Exactive MS是新型四级杆和轨道阱杂交HRMS,在分辨率、扫描速度和灵敏度性能上进一步提升,Q Exactive质谱仪能进行高通量的目标物或非目标物的筛选[19]。
表2 数据解析参考数据库信息
|
数据库名称 |
数据库网址 |
|
Massbank |
http://www.massbank.jp/ |
|
ChemSpider |
http://www.chemspider.com/ |
|
SCIfinder |
https://origin-scifinder.cas.org/ |
|
TCM database |
http://tcm.cmu.edu.tw/ |
|
ChemicalBook |
http://www.chemicalbook.com/ |
根据目标差异性成分MS数据进行MS/MS扫描,并结合数据库(常用的数据库如表2所示)和文献报道(比如黄酮类成分黄酮苷元、氧苷和碳苷的裂解规律,如图5所示)对这些成分进行结构解析。
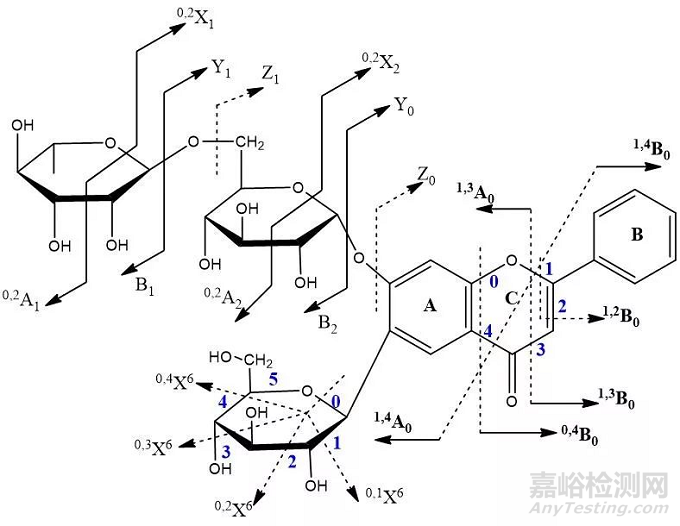
图5 黄酮类成分ESI模式下常见的裂解规律[16]
六、筛选目标成分的验证
显然,接下来我们面临的挑战是对于找到的这些差异成分是否具有生物活性呢?是否能够具有代表性?为此,我们需要一方面通过文献查证,对体内外发现的差异性成分的生物活性进行追踪;另一方面,需要进行不同批次样品给药的重复验证实验,个人推荐至少开展六个批次样品给药实验,以证明发现的含量差异性标志物的稳定性和可靠性。同时,可以采用直接购买相应的标准品,或自己分离制备,亦或自己合成等途径开展离体活性实验是一种很好的选择,比如常见的LPS诱导的细胞炎症模型,肿瘤细胞抑制实验等,并结合Western Blot,ELISA和RT-PCR实验进行表征。最后,所有的结果需要通过体内实验,运用药动学(PK)和药效学(PD)相关实验进行验证。
注意事项:所有的实验方案均需考虑给药剂量的选择、及其与阳性药的可比性、实验对照组设定的合理性和药物浓度依赖性等因素。
结束语
对于一个复杂体系来说,基于组学的方法不失为一种较为准确和精确的方法去鉴别体系中含有的活性成分或Biomarker。采用该方法主是以药物在靶器官或体液中的含量或浓度分布是药物发挥药效为前提条件。当然,药物起效的途径并不局限于此。以中药的多组分体系为例,如王广基院士提出的“脑病外治”的作用机理[20],其指出人参皂苷不直接进入脑内发挥作用,而是通过抑制外周犬尿氨酸的水平,减少进入脑内的犬尿氨酸,阻断外周炎症向脑部的传递,发挥脑神经保护作用。
蔡少青教授提出中药药效物质的“显效形式”新概念及“叠加作用”新假说[21]:中药药效物质显效形式的集合或叠加是药效的核心物质基础,各个显效形式的血药浓度的叠加作用是药效作用机制之一。该方法能够较为完整地呈现体外复杂体系中化学成分的轮廓,同时又能够较好地发现化学成分的吸收、分布和代谢差异。又如刘昌孝院士提出的中药质量标志物(Q-Markers)的新概念[22],基于此我们可以尝试由体内代表性差异成分去建立对体外药材的质量评价和控制的质量成分群,拟为中药物质基础的研究提供数据支持。

来源:药事纵横


