您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-08-27 19:11
为进一步指导和规范可降解封堵器的体系核查工作,上海器审中心组织制定了《可降解封堵器生产环节风险清单和检查指南》,现予发布,内容如下。
可降解封堵器
生产环节风险清单和检查指南
本指南旨在指导和规范可降解封堵器的现场检查工作,帮助医疗器械检查员把握产品风险及检查要求,统一核查尺度,同时也为注册申请人建立及运行质量管理体系的工作提供参考。
本指南是对可降解封堵器开展现场检查的指导性要求,供检查员及注册申请人参考使用,帮助有关人员知晓该类产品的结构组成、作用机理、工艺流程及生产控制过程中的风险要点,不作为法规强制执行。注册申请人应依据申报产品的具体工艺特点,遵循相关法规要求建立质量管理体系并保持有效运行。
本指南是在现行法规和标准体系以及当前科技认知水平和现有产品技术基础上形成的,随着法规和标准的不断完善、科学技术的不断发展,相关人员参考时应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。随着对产品理解的不断深入,本指南相关内容也将适时进行调整。
一、产品和生产信息
(一) 产品简介
1、概述
心脏封堵器是放置于心脏缺损,异常通路或者特殊开口等处,并封堵该位置,以达到阻止异常血流流通的无源外科植入物,主要包括房间隔缺损封堵器、室间隔缺损封堵器、动脉导管未闭封堵器、卵圆孔未闭封堵器和左心耳封堵器等类型。目前市场上封堵器的骨架结构多数为镍钛金属,但镍钛金属的持续机械性压迫可引起迟发的房室传导阻滞,还可引起金属过敏、封堵器相关血栓等多种潜在并发症。
近几年国内外在可降解心脏封堵器的研究取得突破,骨架及阻流体均采用可降解高分子材料制成的完全可降解封堵器、骨架采用可降解高分子材料而阻流体仍采用传统聚酯膜的部分可降解封堵器等均有报道。可降解心脏封堵器植入心脏缺损处后,细胞组织向封堵器内生长并完成内皮化,封堵器逐渐降解,最终实现自身组织替代封堵器的过程,达到完全闭合缺损治愈先天性心脏病的目的。
产品分类:13 无源植入器械
一级产品类别为 07 心血管植入物
二级产品类别为 07 心脏封堵器
2、结构组成
目前不同类型的封堵器的产品结构组成各有不同,但一般由网体骨架结构和阻流体组成,阻流体通常采用缝线缝合在骨架结构上。
封堵器网体一般采用可降解丝编织、定型而成,在临床使用中起到机械支撑的作用。
阻流体可采用可降解膜、高分子聚酯膜等,通过缝线缝合在网体内部,主要起到阻流效果。
3、预期用途
用于治疗先天性心房间隔缺损、心室间隔缺损和动脉导管未闭、卵圆孔未闭等疾病。
4、规格型号
不同类型、不同企业生产的产品对规格型号的划分各有不同。通常依据使用的病变部位和病变大小来划分型号和规格,一般可根据腰高的不同来划分型号,根据腰部直径划分规格。其规格尺寸应具体参照企业的产品技术要求。
5、产品性能(参考技术指标)
5.1 物理性能
5.1.1 外观
5.1.2 尺寸
5.1.3 连接牢固度
5.1.4 螺纹配合(如适用)
5.1.5 弹性形变适应性
5.1.6 稳固性
5.1.7 阻流性能(如渗漏量)
5.1.8 与输送系统的配合性
5.1.9 微粒污染
5.2 化学性能
5.2.1 材质成分
5.2.2 分子量及分子量分布
5.2.3 重金属残留
5.2.4 还原物质、蒸发残渣、酸碱度、紫外吸光度
5.2.5 溶剂残留、单体残留、催化剂残留(如适用)
5.2.6 环氧乙烷残留(如适用)
5.3 微生物性能
5.3.1 无菌
5.3.2 细菌内毒素
5.4 其他性能
5.4.1 降解性能
5.4.2 疲劳性能
(二) 参考文献
GB/T 6040 红外光谱分析方法通则
GB 8368 一次性使用输液器 重力输液式
GB/T 14233.1 医用输液、输血、注射器具检验方法 第 1 部分:化学分析方法
GB/T 14233.2 医用输液、输血、注射器具检验方法 第 2 部分:生物试验方法
GB/T 14233.3 医用输液、输血、注射器具检验方法 第 3 部分:微生物学试验方法
GB/T 16886.1 医疗器械生物学评价 第1 部分:评价与试验
GB/T 16886.3 医疗器械生物学评价 第3 部分:遗传毒性试验
GB/T 16886.4 医疗器械生物学评价 第4 部分:与血液相互作用试验选择
GB/T 16886.5 医疗器械生物学评价 第5 部分:体外细胞毒性试验
GB/T 16886.9 医疗器械生物学评价 第9 部分:潜在降解产物的定性和定量框架
GB/T 16886.10 医疗器械生物学评价 第 10 部分:迟发型超敏试验
GB/T 16886.11 医疗器械生物学评价 第 11 部分:全身毒性试验
GB/T 16886.13 医疗器械生物学评价 第 13 部分:聚合物医疗器械降解产物的定性与定量
GB/T 16886.16 医疗器械生物学评价 第 16 部分:降解产物与可沥滤物毒代动力学研究设计
GB 18279.1 医疗保健产品灭菌 环氧乙烷 第 1 部分:医疗器械灭菌过程的开发、确认和常规控制的要求
GB/T 18279.2 医疗保健产品灭菌 环氧乙烷 第 2 部分:GB 18279.1 应用指南
GB/T 21864 聚苯乙烯的平均分子量和分子量分布的检测标准方法 高效体积排阻色谱法
GB/T 42061 医疗器械 质量管理体系 用于法规的要求
GB/T 42062 医疗器械 风险管理对医疗器械的应用
YY/T 0033 无菌医疗器具生产管理规范
YY 0167 非吸收性外科缝线
YY 0285.1 血管内导管一次性使用无菌导管 第 1 部分:通用要求
YY/T 0313 医用高分子制品包装、标志、运输和储存
YY/T 0473 外科植入物 聚交酯共聚物和共混物体外降解试验
YY/T 0474 外科植入物用 L-丙交酯树脂及制品 体外降解试验
YY 0500 心血管植入物 人工血管
YY/T 0640 无源外科植入物 通用要求
YY/T 0661 外科植入物 半结晶型聚丙交酯聚合物和共聚物树脂
YY 1116 可吸收性外科缝线
YY/T 1553 心血管植入物 心脏封堵器
YY/T 1775.1 可吸收医疗器械生物学评价 第1 部分:可吸收植入物指南
YY/T 1806.1 生物医用材料体外降解性能评价方法 第1 部分:可降解聚酯类
(三) 生产信息
1、工艺流程(示例)
1.1 网体:编网、粗洗与清洗、连接头制作(如适用)、网体定型;
1.2 阻流体:阻流体成型、阻流体粗洗与清洗;
1.3 缝膜、末道清洗、内包装、灭菌、中包装(如适用)、外包装
2、关键原材料
2.1 封堵器网体:如聚对二氧环己酮(PDO)线。可参考 YY 1116《可吸收性外科缝线》制定网体编织线的质量要求。
2.2 阻流体:如聚乳酸膜、聚酯膜等。
2.3 缝线:可参考YY 1116《可吸收性外科缝线》或YY 0167《非吸收性外科缝线》的要求。
3、关键工序和特殊过程
3.1 关键工序:网体定型
3.2 特殊过程:原材料粗洗与精洗(如适用)、连接头制作(如适用)、末道清洗、内包装、灭菌、中包装(如适用)。
4、质量控制点
4.1 编网过程检验
4.2 网体定型过程检验
4.3 缝膜过程检验
4.4 原材料粗洗与精洗控制
4.5 末道清洗控制
4.6 封口检验
4.7 中包装检验(如适用)
4.8 灭菌过程控制
二、可降解封堵器风险管理示例(该示例仅供参考,企业可以结合实际情况,建议按照 ISO14971 或 GB/T42062 提供的方法学来确定产品的伤害严重度水平和伤害发生的概率)
(一) 制定风险可接受准则
风险管理制度的风险可接受标准如下所示。用半定量分析法计算损害概率,用定性分析法分析损害的严重程度。风险可接受标准用 5×55×5 矩阵图表示。
1. 发生概率等级的评定准则(Occurrence)
|
等级 |
定性描述 |
发生概率描述 |
概率(每年) |
|
5 |
频繁 |
几乎是不可避免的 |
>10−1−1 |
|
4 |
很可能 |
经常可能反复发生的 |
10−1−1—10−2−2 |
|
3 |
偶尔 |
反复发生的 |
10−2−2—10−3−3 |
|
2 |
极少 |
发生,但频率不高 |
10−3−3—10−4−4 |
|
1 |
几乎不可能 |
偶然发生 |
≤10−4−4 |
2. 严重度等级的评定准则(Severity)
|
等级 |
对制造/组装过程的影响 |
对用户的影响 |
|
5 |
灾难性的 |
可能会导致死亡:病人死亡。 |
|
4 |
危急的 |
会导致严重的永久伤害:经导管取回时造成栓塞; |
|
3 |
严重的 |
可能会造成损伤,但不严重: |
|
2 |
轻微的 |
短暂的或轻微的受伤、疼痛或不适: |
|
1 |
可忽略的 |
几乎没有受伤: |
3、风险可接受标准
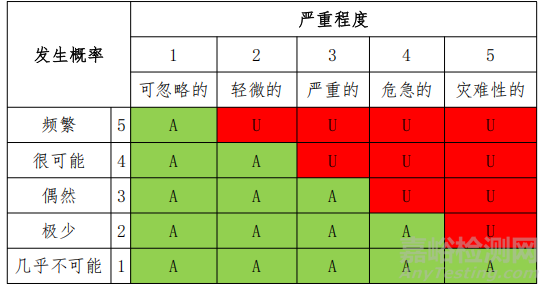
备注:A:可接受的风险;U:没有风险收益分析就被判为不可接受的风险。
4、风险可接受标准系数值分析
根据上述风险可接受标准所构成的风险评价矩阵图,确定风险可接受区域。
风险级别 = 发生概率×严重程度
可接受区A(风险级别:1-9):该区域内,风险是可以接受的。
不可接受的区域U(风险级别:10-25):该区域内,风险如果不能予以降低,则判断为是不可接受的。
(二) 初始危害分析
根据风险管理计划和GB/T 42062 对预期用途和安全相关特征进行了评估,详见附表1《可降解封堵器安全特征检查清单(示例)》所示。
通过填写安全特征检查清单,对产品的安全特征有了初步的了解,并识别出了初始的危害共计14 个,同时对该些危害进行分析,详见附表2《可降解封堵器初始危害分析表(示例)》。
(三) 风险控制措施
经过对以上危害的风险分析,对不同的风险在产品实现全过程中采取了不同的控制措施,经验证有效,风险可控制在可接受范围,详见附表3:《可降解封堵器风险评价、风险控制措施记录表(示例)》。
三、可降解封堵器生产环节风险清单和检查指南
(该部分内容拟为现场检查提供参考,检查员应根据实际情况进行调整)
|
序号 |
风险环节 |
风险点及控制措施 |
检查指南 |
|
1 |
机构和人员 |
一、风险点: |
1. 根据企业注册技术要求等注册批准文件上的检验方法,确认企业是否配备了具备相应资质与能力、足够数量的专职检验员从事相关质量控制工作。可降解封堵器编网、连接头制作、缝膜等通常通过人工操作,现场应重点抽查上述相关人员的实操,如编网人员应熟知模具工装选择、编网手法及路径。 |

来源:Internet


