您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-07-18 20:49
摘 要: 建立测定七味糖脉舒胶囊中人参皂苷Rb1含量的高效液相色谱检测方法。采用EC-C18色谱柱(100 mm×4.6 mm,2.7 μm),以乙腈-水为流动相进行梯度洗脱,流量为1.0 mL/min,检测波长为203 nm,柱温为30 ℃,进样体积为10 μL。人参皂苷Rb1的质量浓度在15.05~300.99 μg/mL范围内与色谱峰面积线性关系良好,相关系数为0.999 9,检出限为0.000 430 mg/g,定量限0.001 08 mg/g。样品加标平均回收率为98.97%,测定结果的相对标准偏差为1.90%(n=6)。该方法操作简单,可用于七味糖脉舒胶囊中人参皂苷Rb1的含量测定。
关键词: 七味糖脉舒胶囊; 人参皂苷Rb1; 高效液相色谱法
七味糖脉舒胶囊由黄芪、红参、五味子、地黄、蜂胶、芹菜子和芫荽7味中药材组成,具有补气滋阴、生津止渴的功效,临床上用于气阴不足所致的消渴,证见口渴消瘦、疲乏无力及2型糖尿病见上述症候者[1]。七味糖脉舒胶囊的现行质量标准为国家药品监督管理局国家药品标准WS-10479 (ZD-0479)-2002-2012Z,该标准仅对组方中黄芪甲苷进行测定。七味糖脉舒胶囊的配伍成分中,黄芪补气升阳、固表止汗、生津养血,红参大补元气、复脉固脱、益气摄血,二者合为君药[1]。红参既是君药又是贵细药材,现代研究表明,红参药材中的皂苷类、挥发油类、氨基酸类、糖类等,具有增强免疫、抗糖尿病、抗氧化等作用[2‒6],同时,红参对糖尿病患者的视网膜具有保护作用[7‒10]。基于红参在七味糖脉舒胶囊中的地位和作用,对其含量进行控制,将有利于药品的质量控制,确保药品的有效性。采用高效液相色谱(HPLC)法测定红参中人参皂苷含量的方法已有文献报道[11‒17],在测定过程中,虽然采用梯度洗脱的方式,但检测时间较长、成本较高,同时由于中成药处方、工艺差异较大,无法直接用于七味糖脉舒胶囊中人参皂苷Rb1的测定。笔者通过对色谱条件的摸索和样品处理条件的优化,建立了测定七味糖脉舒胶囊中人参皂苷Rb1的HPLC法,可为七味糖脉舒胶囊质量标准的制定提供参考。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:1260型,美国安捷伦科技有限公司。
电子天平:SECURA225D-1CN型,感量为0.01 mg,赛多利斯科学仪器(北京)有限公司。
甲醇:色谱纯,德国默克公司。
乙腈:色谱纯,上海星科高纯溶剂有限公司。
正丁醇:分析纯,利安隆博华(天津)医药化学有限公司。
三氯甲烷:分析纯,四川西陇科学有限公司。
氢氧化钠:分析纯,国药集团化学试剂有限公司。
人参皂苷Rb1对照品:纯度(质量分数)为93.8%,批号为110704-202331,中国食品药品检定研究院。
七味糖脉舒胶囊样品:批号分别为231102、231103、231104,昆明龙津药业股份有限公司。
1.2 色谱条件
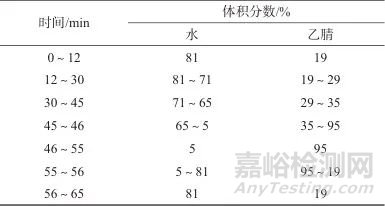
色谱柱:Agilent InfinityLab Poroshell 120 EC-C18柱(100 mm×4.6 mm,2.7 μm,美国安捷伦科技有限公司);流动相:流动相A为水,流动相B为乙腈,流量为1.0 mL/min;洗脱方式:梯度洗脱,洗脱程序见表1;检测波长:203 nm;柱温:30 ℃;进样体积:10 μL。
表1 梯度洗脱程序
Tab. 1 Gradient elution program
1.3 溶液配制
70%甲醇溶液:量取甲醇700 mL,加纯化水至总体积为1 000 mL,摇匀,此溶液作为空白溶液。
人参皂苷Rb1标准贮备液:取人参皂苷Rb1对照品适量,精密称定,加入70%甲醇溶液制成质量浓度为1.5 mg/mL的贮备液。
人参皂苷Rb1系列标准工作溶液:精密量取人参皂苷Rb1对照品贮备液各1 mL,分别置于100、50、20、10 mL容量瓶中,精密量取人参皂苷Rb1对照品贮备液3、2 mL,分别置于20、10 mL容量瓶中,用70%甲醇溶液稀释至标线,摇匀,制备成质量浓度分别为15.05、30.10、75.25、150.50、225.74、300.99 μg/mL的系列标准工作溶液。
1.4 样品处理
取出七味糖脉舒胶囊内容物,研细,取7.0 g,精密称定,置于具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,加热回流1 h。冷却至室温,再称定质量,用甲醇补足减失的质量,摇匀,离心,精密量取上清液25 mL,蒸干,残渣加入30 mL水溶解,用三氯甲烷振摇提取2次,每次30 mL,弃去三氯甲烷液,水溶液用水饱和的正丁醇振摇提取5次,每次20 mL,合并正丁醇液,用1%氢氧化钠溶液洗涤2次,每次30 mL,再用正丁醇饱和的水30 mL洗涤,合并氢氧化钠洗液和水洗液,用水饱和的正丁醇振摇提取3次,每次20 mL,合并正丁醇提取液,并与上述正丁醇液合并,蒸干,残渣用70%甲醇溶液溶解并转移至10 mL容量瓶中,加入70%甲醇溶液至标线,摇匀,滤过,取续滤液,得样品溶液。
按照七味糖脉舒胶囊处方中药材配比及制法,制备不含红参药材的阴性样品,同法制备不含红参的阴性样品溶液。
1.5 实验方法
取人参皂苷Rb1系列标准工作溶液、七味糖脉舒胶囊样品溶液和阴性样品溶液,按1.2色谱条件进行测定,记录色谱图,以色谱峰面积外标法计算样品中人参皂苷Rb1含量。
2 结果与讨论
2.1 色谱条件优化
2.1.1 色谱柱和梯度洗脱条件选择
尝试采用乙腈-水(体积比为30∶70)为流动相等度洗脱,但分离度达不到要求且阴性样品有干扰,故考虑梯度洗脱。以水为流动相A,乙腈为流动相B,设置梯度洗脱程序:0~20 min时B相体积分数为20%,20~45 min时B相体积分数为20%~46%,采用Waters Symmetry shield RP18色谱柱(250 mm×4.6 mm,5 μm)进行样品分析时,人参皂苷Rb1与其前的杂质峰分不开;采用月旭Ultimate PG-C18色谱柱(250 mm×4.6 mm,5 μm)时,人参皂苷Rb1与其前后杂质峰的分离度均小于1.2,分离度较差。为提高分离效果,考虑选择小粒径短柱。选择Agilent InfinityLab Poroshell 120 EC-C18色谱柱(100 mm×4.6 mm,2.7 μm),并进行梯度洗脱程序优化,首先设置梯度洗脱程序:0~20 min时B相体积分数为19%,20~30 min时B相体积分数为19%~30%,30~45 min时B相体积分数为30%~35%,该条件下人参皂苷Rb1与其后的杂质峰不能达到基线分离。调整梯度:0~12 min时B相体积分数为19%,12~30 min时B相体积分数为19%~29%,30~45 min时B相体积分数为29%~35%,该条件下分离度良好,阴性样品无干扰,最终优化结果见表1。
2.1.2 柱温的选择
考察色谱柱温度分别为25、30、35 ℃时人参皂苷Rb1的分离效果。结果表明,上述柱温下,人参皂苷Rb1质量分数测定结果无明显差异,分离效果良好。为满足耐用性要求,故选择柱温为30 ℃。
2.2 样品处理条件优化
2.2.1 提取方式和提取时间选择
在制备七味糖脉舒胶囊样品溶液时,分别考察了超声和回流两种提取方式,结果表明,回流提取时人参皂苷Rb1质量分数测定结果为0.385 5 mg/g,超声提取的测定结果为0.201 5 mg/g,回流提取效果更好,故选择回流提取方式。
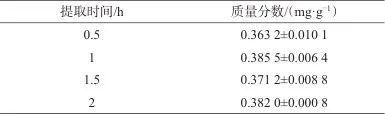
选择提取时间分别为0.5、1、1.5、2 h对七味糖脉舒胶囊样品进行提取,并测定人参皂苷Rb1的质量分数,结果见表2。由表2可知,随着提取时间的延长,人参皂苷Rb1的质量分数增加不明显,故选择提取时间为1 h。
表2 不同提取时间时人参皂苷Rb1的质量分数
Tab. 2 Mass fraction of ginsenoside Rb1 at different extraction times
2.2.2 正丁醇提取次数选择
采用水饱和的正丁醇分别提取4、5、6次,并测定七味糖脉舒胶囊中人参皂苷Rb1的质量分数,结果见表3。由表3可知,用水饱和的正丁醇提取5次时,人参皂苷Rb1的质量分数较大,增加提取次数,质量分数增加不明显,故选择用水饱和的正丁醇提取5次。
表3 不同提取次数时人参皂苷Rb1的质量分数
Tab. 3 Mass fraction of ginsenoside Rb1 at different extraction times

2.2.3 氢氧化钠溶液洗涤次数选择
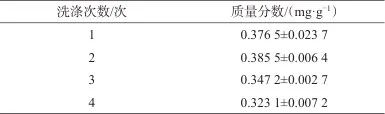
采用1%氢氧化钠溶液分别洗涤1、2、3、4次,并测定七味糖脉舒胶囊中人参皂苷Rb1的质量分数,结果见表4。由表4可知,用1%氢氧化钠溶液洗涤2次时,人参皂苷Rb1的质量分数最高,然后随着洗涤次数增加,质量分数逐渐降低,故选择用1%氢氧化钠溶液洗涤2次。
表4 不同洗涤次数时人参皂苷Rb1的质量分数
Tab. 4 Mass fraction of ginsenoside Rb1 at different washing times
2.3 专属性试验
取空白溶液、人参皂苷Rb1对照品溶液、七味糖脉舒胶囊样品溶液和阴性样品溶液,按1.2色谱条件进行测定,色谱图如图1所示。由图1可以看出,该色谱条件下,人参皂苷Rb1对照品溶液、七味糖脉舒胶囊样品溶液在相同保留时间处具有同一色谱峰,人参皂苷Rb1分离度良好,空白溶液和阴性样品溶液无干扰,表明该方法专属性良好。
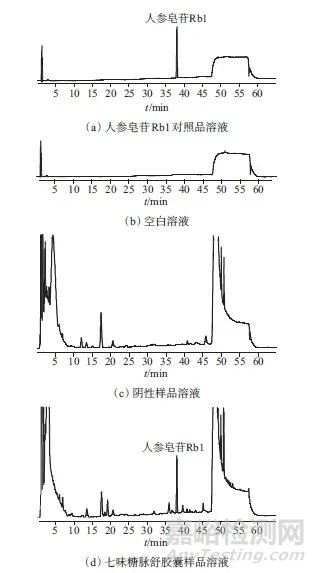
图1 对照品溶液、空白溶液、阴性样品溶液与样品溶液色谱图
Fig. 1 Chromatograms of reference solution,blank solvent,negative sample solution and sample solution
2.4 线性方程与检出限
在1.2色谱条件下,测定人参皂苷Rb1系列标准工作溶液,以人参皂苷Rb1的质量浓度为横坐标,以色谱峰面积为纵坐标进行线性回归,得线性方程为y=2.824 8x+2.041 4,相关系数为0.999 9,表明人参皂苷Rb1的质量浓度在15.05~300.99 μg/mL范围内与色谱峰面积线性关系良好。
取人参皂苷Rb1对照品贮备液,用70%甲醇溶液逐级稀释,按1.2色谱条件测定,分别以3倍信噪比和10倍信噪比对应的质量浓度作为方法检出限和定量限,根据称样质量和定容体积,换算成样品中的含量,以质量分数(mg/g)表示,得检出限为0.000 430 mg/g,定量限为0.001 08 mg/g。
2.5 溶液稳定性试验
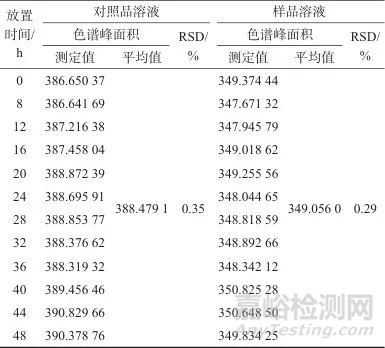
取人参皂苷Rb1对照品溶液和七味糖脉舒胶囊样品溶液,分别于室温放置的第0、8、12、16、20、24、28、32、36、40、44、48 h,按1.2色谱条件进样测定,色谱峰面积测定结果见表5。由表5可知,各时间点对照品溶液和样品溶液中人参皂苷Rb1色谱峰面积测定值的相对标准偏差分别为0.29%和0.35%,表明对照品溶液和样品溶液于室温放置48 h内稳定。
表5 稳定性试验结果
Tab. 5 Results of stability test
2.6 精密度试验
取七味糖脉舒胶囊样品,按1.4方法平行制备6份样品溶液,按1.2色谱条件进行检测,记录色谱图,计算6份样品中人参皂苷Rb1的质量分数,试验结果列于表6。由表6可知,人参皂苷Rb1质量分数的RSD为1.90%,表明该方法精密度良好。
表6 精密度试验结果
Tab. 6 Results of precision test

2.7 样品加标回收试验
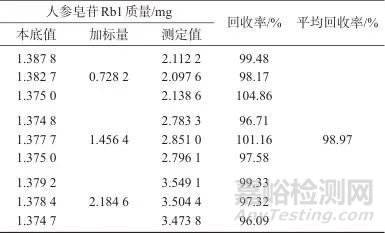
取已知人参皂苷Rb1含量的七味糖脉舒胶囊样品9份,平均每份约3.5 g,精密称定,分成3组,按照低、中、高3个水平进行加标回收试验,分别精密加入人参皂苷Rb1对照品贮备液适量,按1.4样品处理方法制备加标样品溶液,在1.2色谱条件下进行检测,计算平均回收率,结果列于表7。由表7可知,样品加标平均回收率为98.97%,表明该方法准确度良好。
表7 样品加标回收试验结果
Tab. 7 Results of samples spiked recovery test
3 结论
(1) 建立了高效液相色谱法测定七味糖脉舒胶囊中人参皂苷Rb1的含量。对提取方式(超声、回流)、提取时间、提取次数、碱洗次数进行优化,确定了最佳样品处理方法;采用小粒径短柱,在提高分离度的同时,缩短了分析时间,降低了检测成本,提高了检验效率。
(2) 在色谱柱选择和梯度优化过程中同时考察了人参皂苷Rg1和人参皂苷Re的分离情况,但由于二者在七味糖脉舒胶囊中的含量不高,考虑到检测成本,最终只检测了人参皂苷Rb1,后期将根据品种需要补充相关试验同时进行人参皂苷Rg1和人参皂苷Re控制。
(3) 该方法操作简单、精密度好、准确度和灵敏度高,具有良好的线性关系,可用于七味糖脉舒胶囊的质量控制。
参考文献
1 曲颂杨,关开,胡航,等.七味糖脉舒片HPLC指纹图谱建立及其中6种成分同时测定[J].国际药学研究杂志,2020,47(6): 477.
QU Songyang,GUAN Kai,HU Hang,et al. Establishment of HPLC fingerprints of Qiwei Tangmaishu tablet and simultaneous determination of six constituents[J].Journal of International Pharmaceutical Research,2020,47(6): 477.
2 樊伟旭,詹志来,侯芳洁,等.红参的化学成分及药理作用研究进展[J].天然产物研究与开发,2021,33: 137.
FAN Weixu,ZHAN Zhilai,HOU Fangjie,et al. Research progress on chemical constituents and pharmacological activities of Ginseng Radix et Rhizoma Rubra[J]. Natural Product Research Develepment,2021,33: 137.
3 齐梦含,郑毅男,李伟.红参中氨基酸糖苷类化学成分研究进展[J].中草药,2024,55(19): 6 779.
QI Menghan,ZHENG Yinan,LI Wei. Research progress on chemical constituents of amino acid glycosides of Ginseng Radix et Rhizoma Rubra[J]. Chinese Traditional and Herbal Drugs,2024,55(19): 6 779.
4 汤淼淼,赵姝婷,李冉琪,等.红参的炮制方法、化学成分及药理研究进展[J/OL].特产研究.[2024-12-05]. https://doi.org/10.16720/j.cnki.tcyj.2024.037.
TANG Miaomiao,ZHAO Shuting,LI Ranqi,et al. Research prosress on processing methods,chemical compesition and pharmacology of Red Ginseng[J/OL]. Special Wild Economic Animal and Plant Research.[2024-12-05]. https://doi.org/10.16720/j.cnki.tcyj.2024.037.
5 毛蕊,丁传波,张帅,等.红参的生物活性及综合利用研究概况[J].上海中医药杂志,2024,58(2): 11.
MAO Rui,DING Chuanbo,ZHANG Shuai,et al. Overview of biological activities and comprehensive utilization of Ginseng Radix et Rhizoma Rubra[J].Shanghai Journal of Traditional Chinese Medicine,2024,58(2): 11.
6 周秋秋,任谓明,王艳红,等.红参的炮制、化学成分及药理活性研究进展[J].上海中医药杂志,2016,50(2): 97.
ZHOU Qiuqiu,REN Weiming,WANG Yanhong,et al. Research progress on processing drugs methods,chemical composition and pharmacological activity of red ginseng[J]. Shanghai Journal of Traditional Chinese Medicine,2016,50(2): 97.
7 李立定,周华丽,王鹏,等.红参粉末治疗糖尿病视网膜病变的临床观察[J].现代生物医学进展,2013,13(29): 5 772.
LI Liding,ZHOU Huali,WANG Peng,et al. Observation about the clinical effects of Red Ginseng powder on the treatment of diabetics Retinopathy[J]. Progress in Modern Biomedicine,2013,13(29): 5 772
8 邓辉,金明,潘琳,等.红参对糖尿病大鼠视网膜血管内皮细胞生长因子表达及神经节细胞凋亡的影响[J].中日友好医院学报,2010,24(2): 94.
DENG Hui,JIN Ming,PAN Lin,et al. Ginseng on vascular endothelial growth factor expression and retina ganglion cells apoptosis in diabetic rats[J]. Journal of China-Japan Friendship Hospital,2010,24(2): 94.
9 张瀚文,石岩.黄芪-红参治疗糖尿病视网膜病变的潜在靶点及网络药理学作用机制研究[J].中华中医药学刊,2021,39(5): 101.
ZHANG Hanwen,SHI Yan. Study on potential targets and network pharmacological mechanisms of Huangqi(Astragali Radix)-Hongshen(Ginseng Radix Et Rhizoma Rubra) for diabetic retinopathy[J]. Chinese Archives of Traditional Chinese Medicine,2021,39(5): 101.
10 邓辉,金明,潘琳,等.红参对糖尿病视网膜神经节细胞的神经保护作用[J].中国中医眼科杂志,2004,14(2): 5.
DENG Hui,JIN Ming,PAN Lin,et al. An experimental research on protective effect of ginseng in retinal ganglion cells with diabetes mellitus[J]. China Journal of Chinese Ophthalmology,2004,14(2): 5.
11 辛旭阳,邹桂欣,赵玥,等.化胃舒颗粒中红参的皂苷类成分含量测定方法及其降解产物研究[J].中南药学,2022,20(2): 415.
XIN Xuyang,ZOU Guixin,ZHAO Yue,et al. Content determination of ginsenosides and degradation products of red ginseng in Huaweishu granules[J].Central South Pharmacy,2022,20(2): 415.
12 毕福钧,钟顺好,顾利红. RRLC法与HPLC法在红参和西洋参人参皂苷含量测定中的分析比较[J].药物分析杂志,2010,30(9): 1 720.
BI Fujun,ZHONG Shunhao,GU Lihong. Comparison between RRLC and HPLC for determination of ginsenoside Rg1,Re and Rb1 in radix et Rhizom a Ginseng Rubra and Radix Panacis Quinuefolii[J]. Chinese Journal of Pharmaceutical Analysis,2010,30(9): 1 720.
13 刘慧,唐心恬,娄慧慧,等.高效液相色谱法同时测定还脑益聪方中7种人参成分含量[J].时珍国医国药,2022,33(12): 2 933.
LIU Hui,TANG Xintian,LOU Huihui,et al. Determination content of 7 components in Huan-Nao-Yi-Cong-Fang by HPLC[J]. Lishizhen Medicine and Materia Medica Research,2022,33(12): 2 933.
14 刘艳玲,于艳,田原,等.高效液相色谱法测定温阳活血软胶囊中7种成分的含量[J].辽宁中医杂志,2021,48(5): 133.
LIU Yanling,YU Yan,TIAN Yuan,et al. Determination of seven constituents in Wenyang Huoxue Soft Capsule by HPLC[J].Liaoning Journal of Traditional Chinese Medicine,2021,48(5): 133.
15 刘巧明,奉建芳,梁健钦,等.复方扶芳藤合剂和复方扶芳藤胶囊剂生产后药渣中有效成分的含量测定[J].广东药科大学学报,2021,37(1): 34.
LIU Qiaoming,FENG Jianfang,LIANG Jianqin,et al. Determination of active ingredient in herbal residue from Fufang Fufangteng mixture and Fufang Fufangteng capsule[J]. Journal of Guangdong Pharmaceutical University,2021,37(1): 34.
16 刘光斌,王艳,张玉叶,等.红参川贝咳喘丸的质量控制方法研究[J].中兽医医药杂志,2019,38(5): 50.
LIU Guangbin,WANG Yan,ZHANG Yuye. Study on quality control method for Hongshen Chuanbei Kechuan pills[J]. Journal of Traditional Chinese Veterinary Medicine,2019,38(5): 50.
17 张月如,赵景莹,汤慧丽,等.高效液相色谱法测定人参属植物提取物中9种人参皂苷[J].化学分析计量,2024,33(11): 26.
ZHANG Yueru,ZHAO Jingying,TANG Huili,et al. Determination of 9 ginsenosides in extracts of panax species by high performance liquid chromatography[J]. Chemical Analysis and Meterage,2024,33(11): 26.

来源:化学分析计量


