今日头条
默沙东FIC抗癌新药中国报产。默沙东缺氧诱导因子-2α(HIF-2α)抑制剂Belzutifan的5.1类化药上市申请获CDE受理,用于治疗von Hippel-Lindau(VHL)病相关肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)。今年2月,该新药已被CDE纳入优先审评。Belzutifan是FDA批准的首个HIF-2α抑制剂,除上述适应症外,该产品还被批准用于治疗晚期肾细胞癌经治患者。
国内药讯
1.百济神州PD-1获批美国上市。百济神州PD-1抑制剂Tevimbra(tislelizumab,替雷利珠单抗)获FDA批准上市,这是该新药的首个美国上市许可,用于单药治疗既往接受过一线标准化疗、不可切除或转移性食管鳞状细胞癌(ESCC)。在Ⅲ期RATIONALE 302临床中,替雷利珠单抗在ITT人群的中位总生存期达8.6个月,降低死亡风险超过30%。在中国,该疗法已有12个适应症获批。
2.恒瑞PD-1将亮相ELCC2024。恒瑞医药将在ELCC2024年会上公布其PD-1抑制剂卡瑞利珠单抗联合化疗一线治疗晚期非鳞状非小细胞肺癌(NSCLC)的CameL 3期研究5年长期随访结果。中位随访为65.2个月时,卡瑞利珠单抗联合化疗组的中位总生存期(OS)为27.1个月,而化疗组的中位OS为19.8个月;两组5年OS率分别为31.2%和19.3%。此外,研究未发现新的安全信号,也没有发现卡瑞利珠单抗的长期暴露会产生累积毒性的明显证据。
3.AZ酶替代疗法启动国际Ⅲ期临床。阿斯利康重组碱性磷酸酶ALXN1850在中国启动了两项国际(含中国)Ⅲ期临床,评估ALXN1850皮下给药治疗既往未接受过 Asfotase Alfa治疗的低磷酸酯酶症(HPP)儿童(2岁至<12岁)患者,以及青少年(≥12岁至<18岁 )和成年患者的有效性和安全性。两项研究的中国部分分别由首都医科大学附属北京儿童医院巩纯秀主任医师和中国医学科学院北京协和医院夏维波主任医师牵头开展。
4.迈威妇科肿瘤ADC亮相SGO年会。迈威生物靶向Nectin-4的ADC创新药9MW2821在SGO年会上公布了其Ⅰ/Ⅱ期临床中宫颈癌队列的最新数据。在可评估患者中,9MW2821的客观缓解率(ORR)和疾病控制率(DCR)分别为40.54%和89.19%;在Nectin-4肿瘤细胞染色强度3+(Nectin-4 3+)患者中,ORR和DCR分别为50.00%和92.31%。9MW2821在宫颈癌治疗中安全性良好,有望为复发或转移性宫颈癌的治疗带来新的突破。
5.诺和诺德地贫新药中国获批IND。诺和诺德1类化药etavopivat获国家药监局临床许可,拟开发治疗地中海贫血。etavopivat是Forma Therapeutics(已被诺和诺德收购)开发的一款选择性丙酮酸激酶-R(PKR)激动剂,已在Ⅰ期临床中显示出具有改善红细胞健康、增加血红蛋白含量、减少病患复发性血管闭塞危象(VOC)症状等潜力。此前,FDA已授予etavopivat快速通道资格、罕见儿科疾病认定与孤儿药资格。
国际药讯
1.首款NASH新药获FDA批准上市。Madrigal公司口服选择性甲状腺激素受体(THR)-β激动剂Rezdiffra(resmetirom)获FDA加速批准上市,成为首款针对NASH基础病因的创新药,用于联合饮食和运动治疗患有中重度肝纤维化(F2至F3期)的非肝硬化非酒精性脂肪性肝炎(NASH)/代谢功能障碍相关脂肪性肝炎(MASH)成人患者。在Ⅲ期MAESTRO-NASH试验中,resmetirom(100mg)治疗52周后,患者肝脏脂肪水平平均降低51%;肝纤维化、肝脏体积和脾脏体积也显著降低。
2.Biohaven公司癫痫新药启动Ⅲ期临床。Biohaven公司针对癫痫、情绪障碍和疼痛开发的高选择性Kv7.2/7.3激活剂BHV-7000,在Clinicaltrials.gov网站上注册了一项Ⅱ/Ⅲ期临床RISE 3研究,评估用于治疗成人难治性局灶性癫痫的有效性与安全性。Ⅰ期临床结果显示,BHV-7000与其他抗惊厥药物(ASM)相比,具有差异化和潜在的良好临床特征,其药代动力学数据支持Ⅱ/Ⅲ期临床采用每日一次的缓释制剂。该项目预计2025年8月完成。
3.安进启动K药类似药Ⅲ期临床。安进生物类似药ABP 234在Clinicaltrials.gov网站上注册了一项Ⅲ期临床,计划入组927例晚期或转移性非鳞状非小细胞肺癌患者,评估ABP 234与Keytruda对比的治疗效果、药代动力学、安全性和免疫原性。该项试验预计2027年10月完成。经查询,Keytruda美国专利保护期至2028年,欧洲专利保护期至2031年,日本保护期至2032-2033年,中国专利保护期至2028年。
4.罗氏引进现货型CAR-T获孤儿药资格。Poseida公司与罗氏开发靶向BCMA的同种异体CAR-T疗法P-BCMA-ALLO1获FDA授予孤儿药资格,用于治疗多发性骨髓瘤(RRMM)。Ⅰ期临床结果显示,在接受充分淋巴细胞耗竭的强化预治疗患者中,P-BCMA-ALLO1治疗的客观缓解率(ORR)为82%;在既往未接受过BCMA靶向双特异性T细胞衔接抗体治疗患者中,ORR则为100%。两家公司计划在AACR2024年会上公布更多P-BCMA-ALLO1最新数据。
5.Asgard公司融资开发抗癌免疫疗法。Asgard公司宣布完成3000万欧元的A轮融资,以用于支持其潜在“first-in-class”、现货型基因疗法AT-108完成IND递交。AT-108是基于一种复制缺陷的腺病毒载体疗法,旨在将三种转录因子递送到肿瘤细胞中,通过重新编程癌细胞成为具有免疫原性的常规1型树突状细胞(cDC1s),以达到触发个体化和系统性的抗癌免疫反应。本轮融资由RV Invest和强生创新(JJDC)共同领投。
6.BMS终止一项CTLA-4抗体前药合作。CytomX公司日前透露,百时美施贵宝已终止了双方在CTLA-4靶点方面的合作项目,不再继续开发CTLA4 probody(抗体前药)BMS-986288。受此消息影响,CytomX公司股价下跌,目前市值仅剩1.46亿美元。BMS-986288是基于CytomX公司专有probody平台开发的非岩藻糖基化伊匹木单抗,具有可增强抗原递呈细胞介导的T细胞引诱和调节性T细胞(Treg)调节的潜力。
医药热点
1.浙江HPV疫苗接种调整。据杭州日报3月16日报道,浙江省疾控中心明确调整HPV疫苗免疫程序。在9-14岁女性中,二价和九价疫苗可选择2剂次的免疫程序,即0、6月分别接种1剂次,间隔不小于5个月,也可选择3剂次的免疫程序;15-45岁女性中仍然只能选择接种3剂次的免疫程序。另外,目前已上市的HPV疫苗中,四价疫苗完成全程免疫均需接种3剂次。
2.我国儿童青少年总体近视率下降。3月13日,国家疾控局发布最新监测数据显示:2022年我国儿童青少年总体近视率为51.9%,总体近视率较2021年(52.6%)下降0.7个百分点,与2018年全国近视摸底调查结果(53.6%)相比,下降1.7个百分点;在已经近视的学生中,轻、中、高度近视分别占53.3%、37.0%、9.7%,高度近视比例降低,我国近视防控工作取得积极成效。
3.辉瑞首席执行官2023年薪酬下降35%。近日,辉瑞在一份监管文件中披露,其首席执行官(CEO)Albert Bourla 2023年薪酬为2156.21万美元,与2022年的3301.75万美元相比,下降35%。Albert Bourla薪酬的最大变化是非股权激励计划薪酬,从765万美元降为0,公司其他高管也均未获得此类奖项。2023年,该公司营收目标是688亿美元,但实际上只有585亿美元。
评审动态
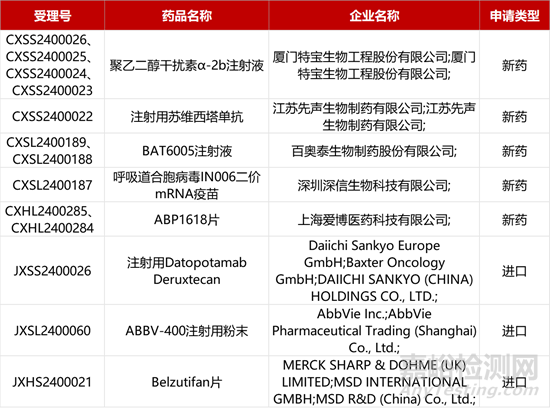
1. CDE新药受理情况(03月18日)
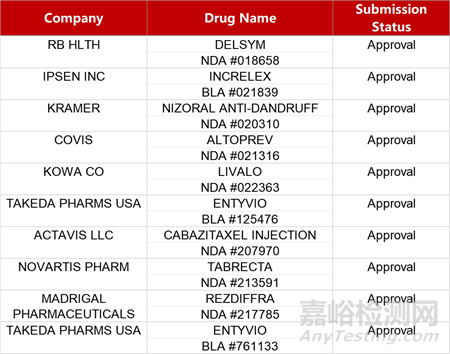
2. FDA新药获批情况(北美03月15日)