今日头条
加科思SHP2抑制剂获批肺癌III期临床。加科思药业SHP2抑制剂JAB-3312获国家药监局批准开展注册性III期临床,与KRAS G12C抑制剂戈来雷塞联合用药,评估用于一线治疗KRAS G12C突变、非小细胞肺癌(NSCLC)患者的有效性与安全性。公布于ESMO2023年会上的数据显示,JAB-3312单药在NSCLC患者的客观缓解率(ORR)为65.5%,疾病控制率(DCR)为100%;JAB-3312与戈来雷塞联用的ORR达到86.7%。
国内药讯
1.诺贝仁「醋酸锌片」获批上市。诺贝仁制药5.1类新药醋酸锌片获国家药监局批准上市,用于治疗肝豆状核变性(又称Wilson病,威尔逊病)。这种罕见的遗传性疾病会阻碍患者的肝脏排出过量的铜,导致铜在肝、大脑、眼球等器官的积聚。醋酸锌片(zinc acetate,商品名为Nobelzin)是一款铜吸收抑制剂,已在日本获批上市,用于治疗肝豆状核变性、低锌血症。
2.恒瑞IL-17A单抗报强直性脊柱炎NDA。恒瑞医药旗下盛迪亚自主研发的创新药夫那奇珠单抗注射液(SHR-1314)的上市申请获CDE受理,用于治疗活动性强直性脊柱炎成人患者。SHR-1314是一款靶向IL-17A的IgG1单抗,通过与IL-17A结合后抑制下游细胞因子,以阻断炎症信号的传导。去年4月,SHR-1314首次在国内申报上市,针对的适应症为斑块型银屑病。
3.蔼睦引进泪小管植入剂在新加坡报产。蔼睦医疗从Ocular公司引进的地塞米松眼用植入剂DEXTENZA的新药上市申请获得新加坡药监部门受理,适应症为“眼科手术后炎症和疼痛、过敏性结膜炎有关的眼部瘙痒”。Dextenza不含防腐剂,单次插入可持续释放地塞米松长达30天。蔼睦医疗拥有该产品在大中华区、韩国和东盟市场开发和商业化独家权益。
4.迈威B7-H3靶向ADC获批美国临床。迈威生物靶向B7-H3的ADC产品7MW3711获FDA临床许可,拟开发用于治疗晚期恶性实体瘤。7MW3711可与肿瘤细胞表面的抗原B7-H3结合内吞进入肿瘤细胞,通过特定酶解作用,定向释放小分子,从而实现对肿瘤的精准杀伤。在临床前研究中,7MW3711在多种动物肿瘤模型中均显示出积极的肿瘤杀伤作用;且具有良好的安全性及药代特性。该产品去年已在国内获批IND。
5.凡恩世Claudin 18.2/CD47双抗国内获批临床。凡恩世制药靶向Claudin18.2和CD47的双特异性抗体PT886获国家药监局临床默示许可,拟开发治疗晚期实体瘤(包括胃癌,胃食管交界处癌和胰腺癌)。在美国胃癌、胃食管交界处癌和胰腺癌患者中开展的Ⅰ期临床中,PT886已获得良好的安全性数据和初步疗效结果。FDA已授予该新药用于治疗胰腺癌的孤儿药资格。
国际药讯
1.AZ奥希替尼获批一线治疗NSCLC。阿斯利康第三代EGFR抑制剂奥希替尼获FDA批准新适应症,联合化疗一线治疗携带EGFR突变的非小细胞肺癌(NSCLC)患者。在III期Flaura2研究中,与奥希替尼单药相比,研究者和BICR评估的奥希替尼联合化疗将患者中位PFS分别延长8.8个月和9.5个月,患者疾病进展或死亡风险降低了38%。
2.AZ/第一三共TROP2-ADC报肺癌BLA。阿斯利康与第一三共开发的靶向TROP2的ADC药物Dato-DXd(Datopotamab deruxtecan)的生物制品许可申请(BLA)获FDA受理,用于治疗局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)经治患者。PDUFA日期为2024年第四季度。在III期TROPION-Lung01研究中,Dato-DXd相比多西他赛在全分析集(FAS)中取得有统计学差异的无进展生存期(PFS)改善(4.4个月vs3.7个月,HR 0.75);其中非鳞癌亚组中观察到更长的中位PFS(5.6vs3.7个月,HR 0.63)。
3.强生FcRn单抗获HDFN突破性疗法认定。强生靶向新生儿Fc受体(FcRn)抗体药物nipocalimab获FDA突破性疗法认定,用于治疗有高风险出现严重新生儿溶血病(HDFN)的孕妇。Ⅱ期临床(UNITY)32周治疗结果显示,接受治疗的13例孕妇中有12例受试者成功生产;并且有54%的孕妇不需要宫腔内输血(IUT)可成功生下婴儿。今年2月初,nipocalimab用于治疗重症肌无力(gMG)的Ⅲ期临床VIVACITY也达到主要终点,nipocalimab治疗患者的MG-ADL评分在22-24周时较安慰剂显著降低。
4.Rocket公司罕见病基因疗法上市延期。FDA延长了Rocket Pharmaceuticals基因疗法KRESLADI™(RP-L201,marnetegragene autotemcel)用于治疗严重白细胞粘附缺陷-I(LAD-I)的生物制品许可申请(BLA)的优先审查期,PDUFA日期由今年3月31日延长至6月30日。FDA尚无召开咨询委员会会议的计划,延期或与FDA自身人员配置问题有关。RP-L201含有自体造血干细胞,在体外使用慢病毒载体进行基因工程改造,能够使ITGB2基因正常表达。
5.安斯泰来拟8亿美元开发体内CAR-T疗法。安斯泰来旗下子公司Xyphos与Kelonia Therapeutics达成合作和许可协议,将利用其专有ACCELTM技术(应用可转换嵌合抗原受体convertibleCAR于免疫细胞的技术平台)与后者iGPS技术(体内基因定位系统)相结合,合作开发两款新型体内CAR-T疗法。根据协议,Kelonia将获得7500万美元的预付款和研发资金,以及里程碑后期款项。两个项目总额接近8亿美元。
6.诺和诺德IL-21单抗授权Almirall公司。Almirall公司宣布与诺和诺德就后者在研IL-21单抗NN-8828达成合作许可协议,获得该新药应用于免疫炎症性皮肤病等领域的全球独家开发和商业化权利。NN-8828可阻断IL-21下游信号通路的激活,并抑制该细胞因子在多种免疫细胞中诱导的病理生理功能。根据协议,诺和诺德将获得预付款,产品开发和商业里程碑后期付款,以及产品全球销售的分成。
医药热点
1.孙剑履新南方医科大学南方医院院长。近日,南方医科大学南方医院官网“现任领导”一栏更新信息显示,孙剑已任南方医科大学南方医院党委副书记、院长。据南方医科大学南方医院官网信息显示,孙剑,男,南方医科大学教授、主任医师、博士生导师。此前,孙剑任该院副院长一职。
2.国家脊灰病毒封存监管机构成立。近日,国家卫健委、国家疾控局联合国家药监局发布《关于成立国家脊灰病毒封存监管机构的通知》,旨在践行我国对世界消灭脊灰病毒行动的承诺,统筹推进我国脊灰病毒封存认证工作。通过成立国家脊灰病毒封存监管机构,对保存有脊灰病毒的相关机构的设立和运行进行监管,可以有效地降低生物安全风险,保障相关疫苗的研发和使用。监管机构办公室设在国家卫健委科教司,承担监管机构的日常工作。
3.韩国:医学院扩招引发医生辞职潮。因反对政府提出的医学院扩招计划,日前,韩国首都圈5所大型医院、约2700名住院医师决定集体辞职。18日,韩国总理韩德洙发表国民谈话称,若医生们集体辞职,将导致医疗服务空白。他敦促医生们保持克制、坚守岗位。韩政府近日还要求各家医院每日汇报实习住院医生辞职、休假、离岗等情况。该部表示,将严惩拒不返岗者,选项包括吊销医师执照。
评审动态
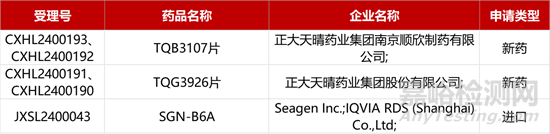
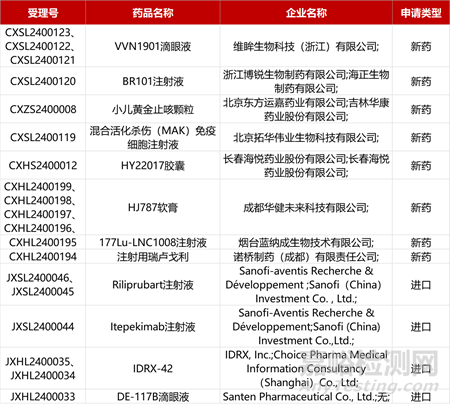
1. CDE新药受理情况(02月09日)
2. FDA新药获批情况(北美02月19日)