今日头条
恒瑞MOR靶向镇痛药获批上市。恒瑞医药1类新药富马酸泰吉利定注射液(SHR8554)获国家药监局批准上市,适用于腹部手术后中重度疼痛。SHR8554可激活μ阿片受体(MOR),选择性地激活G蛋白偶联通路,具有中枢镇痛效果的同时,可减轻胃肠道不良反应和减少呼吸抑制不良反应的发生率。今年1月,CDE已受理该新药提交的“骨科手术后镇痛”新适应症上市申请。
国内药讯
1.和黄「呋喹替尼」获批香港上市。和黄医药VEGFR抑制剂呋喹替尼(fruquintinib)获香港监管部门批准上市,用于治疗既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗VEGF治疗、抗EGFR治疗(RAS野生型)的转移性结直肠癌患者。在国际III期试验 (MRCT) FRESCO-2研究中,与安慰剂相比,呋喹替尼治疗组的mOS延长2.6个月,mPFS延长1.9个月。
2.科笛引进非那雄胺喷雾剂报产。科笛集团从Polichem公司引进的外用非那雄胺喷雾剂CU-40102的新药上市申请(NDA)获CDE受理,用于治疗雄激素性脱发。与口服非那雄胺不同,CU-40102可直接精确地涂抹在头皮表面,保持用药部位高浓度并减少药物全身暴露。在Ⅲ期临床中,CU-40102治疗组24周时患者的顶部秃发目标区域内的总毛发计数及终毛计数的统计较安慰剂显著改善。
3.辉瑞CD3/BCMA双抗中国报产。辉瑞CD3/BCMA双抗Elranatamab(Elrexfio,PF-06863135)的上市申请获CDE受理,用于治疗复发或难治性多发性骨髓瘤(R/R MM)。在II期研究MagnetisMM-3(NCT04649359)研究中,elranatamab在既往至少接受过四种治疗的患者中达到61%的客观缓解率以及56.1%的非常好的部分缓解率。去年8月,该产品已获FDA加速批准上市,成为第二款在美获批的CD3/BCMA双抗。
4.驯鹿BCMA靶向CAR-T见刊PNAS。驯鹿生物靶向BCMA的CAR-T产品伊基奥仑赛注射液(CT103A)在研究者发起的一项针对免疫介导坏死性肌病(IMNM)的探索性研究(NCT04561557)中获积极结果。CT103A回输18个月后,患者徒手肌力检查(MMT-8)评分从基线的96分,改善至137分;血清肌酸激酶水平从4778 IU/L降至260 IU/L,肌红蛋白水平从837 ng/mL降至66.2 ng/mL;临床中未发现新的安全性风险。详细结果发表在《美国国家科学院院刊》(PNAS)上。
5.荣昌预计2023年营收10.8亿元。荣昌生物发布2023年年度业绩预告,预计2023年度营业收入约108,000万元,较上年同期将增加收入约31,000万元,同比增加约40%;预计实现归属于母公司所有者的净亏损约155,000万元,较上年同期将增加亏损约55,200万元,同比亏损增加约55%;预计归属于母公司所有者扣除非经常性损益后的净亏损约158,000万元,较上年同期将增加亏损约46,400 万元,同比亏损增加约42%。
6.中国生物制药南方总部开业运营。1月31日,中国生物制药南方总部在广州国际生物岛正式开业。南方总部目前已引入包括治疗非酒精性脂肪性肝炎的拉尼兰诺、软雾吸入药械平台Softhale和新一代肿瘤免疫疗法等海外临床项目。未来,中国生物制药将通过南方总部和海外子公司invoX,引进全球领先的药品管线,并在广州实现临床转化和产业化。
国际药讯
1.BMS靶向CD19自体CAR-T报两项sBLA。FDA受理百时美施贵宝CD19靶向CAR-T疗法Breyanzi(Liso-cel)两项补充生物制品许可申请(sBLA),用于治疗复发或难治性滤泡性淋巴瘤(FL)和套细胞淋巴瘤(MCL)经治患者。FDA同时授予它们优先审评资格,PDUFA日期分别为今年5月23日和5月31日。在临床试验中,Breyanzi在复发/难治性FL患者中达到97%(p<0.0001)总缓解率(ORR);在MCL患者达到86.5%的ORR。
2.强生CD38单抗皮下注射制剂报新适应症。强生CD38抗体皮下注射制剂Darzalex Faspro(daratumumab)已向FDA提交补充生物制品许可申请(sBLA),联合硼替佐米、来那度胺和地塞米松(D-VRd)用于适合接受自体干细胞移植(ASCT)的新诊断多发性骨髓瘤成人患者的诱导和巩固治疗,以及之后联合来那度胺(D-R)用于维持治疗。在III期PERSEUS研究中,47.5个月随访数据显示,daratumumab联合方案使疾病进展风险降低58%。
3.NaV1.8抑制剂两项止痛Ⅲ期临床积极。Vertex公司选择性NaV1.8抑制剂VX-548用于术后(腹部整形手术和拇囊炎切除手术)中重度急性疼痛治疗的两项Ⅲ期临床均达到主要终点。与安慰剂相比,VX-548组患者48小时内疼痛强度差异的时间加权总和评分(SPID48)显著降低,SPID48的平均差异分别为48.4(P<0.0001)和29.3(P=0.0002);但与羟考酮/对乙酰氨基酚(HB/APAP)组合相比,VX-548组SPID48的改善没有达到优效标准。VX-548总体耐受性良好。
4.新型反义RNA疗法治疗DMD的Ⅱ期临床积极。Sarepta公司多肽磷酰二胺吗啉寡聚体(PPMO)疗法SRP-5051(vesleteplirsen)治疗适于使用外显子51跳跃治疗的杜氏肌营养不良(DMD)患者的国际Ⅱ期临床MOMENTUM(SRP-5051-201研究)结果积极。在28周时,SRP-5051(30mg/kg,每4周一次)可使抗肌萎缩蛋白的平均表达水平达到5.17%(较基线提高4.53%,P<0.0001);平均外显子跳跃率达到11.11%(较基线提高10.07%)。此外,患者在预防性地接受补充镁治疗后,未发生与治疗相关的停药。
5.SLC6A19别构抑制剂PKU早期临床积极。Jnana公司靶向苯丙氨酸(Phe)转运蛋白SLC6A19的潜在“first-in-class”小分子抑制剂JNT-517,在治疗苯丙酮尿症(PKU)患者的Ⅰ期临床获积极结果。与安慰剂相比,JNT-517组第28天患者的平均血液Phe水平显著降低51%(p=0.0019);患者临床应答率达到88%;药物安全性良好。Jnana计划在今年下半年与监管机构沟通,寻求明年直接将JNT-517推进至关键Ⅲ期临床。
6.赛诺菲布局IL-10R激动剂。赛诺菲宣布与Synthekine公司达成合作许可协议,获得后者专有蛋白质工程平台优化的多种IL-10R激动剂的临床前、开发和商业化权益,用于治疗炎症性疾病。工程化蛋白分子可选择性地激活特定细胞上的细胞因子信号传导,从而最大限度地提高疗效并降低毒性。根据协议,Synthekine将获得4000万美元的预付款,临床前、开发、监管和商业里程碑潜在付款,以及产品的分级特许权使用费。
7.司美格鲁肽2023年大卖212亿美元。1月31日,诺和诺德发布2023年Q4及全年业绩。2023年总销售额为2322.61亿丹麦克朗(约337.01亿美元),同比增长31%。司美格鲁肽全年总销售额达到约211.58 亿美元:司美格鲁肽注射液Ozempic(2型糖尿病)收入957.18亿丹麦克朗(139.17亿美元,+60%);司美格鲁肽片剂Rybelsus(2型糖尿病)收入187.50亿丹麦克朗(27.26亿美元,+66%);司美格鲁肽注射液Wegovy(肥胖)收入313.43亿丹麦克朗(45.57亿美元,+407%)。
医药热点
1.南京鼓楼医院互联网医院服务再升级。近日,南京鼓楼医院互联网医院线上复诊医保在线支付开通,旨在解决患者因时间、空间无法到线下医院复诊开药的问题,同时医保报销节省看病费用。患者授权医保电子凭证后,即可享受“在线复诊—续方开药、开检查—医保支付—药品配送”的一体化医疗服务,线上复诊的挂号费及后续药费、检查费均可医保线上支付,切实给患者带来便利。
2.浙江报告1例H3N2与H10N5混合感染死亡病例。据国家疾控局30日通报,浙江省发现一例H3N2与H10N5混合感染病例。患者,女,63岁,安徽宣城人,既往有多种基础性疾病。2023年11月30日出现咳嗽、咽痛、发热等症状;12月2日因病情加重收入当地医疗机构救治;12月7日,转至浙江省医疗机构住院治疗,后因病情严重于12月16日死亡。专家评估认为,此次疫情为一次偶发的禽到人的跨种属传播。该病毒感染人的风险低,未发生人传人的情况。
评审动态
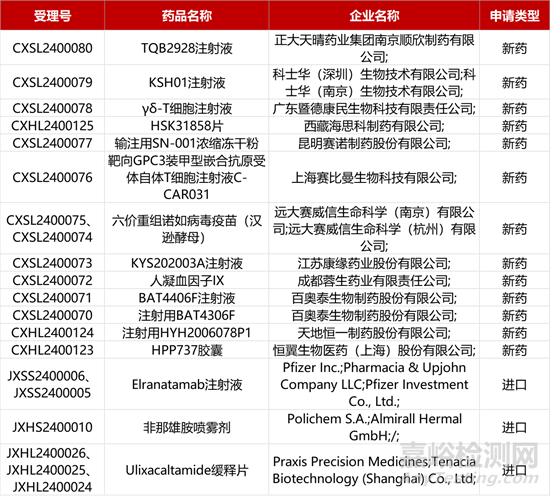
1. CDE新药受理情况(01月31日)
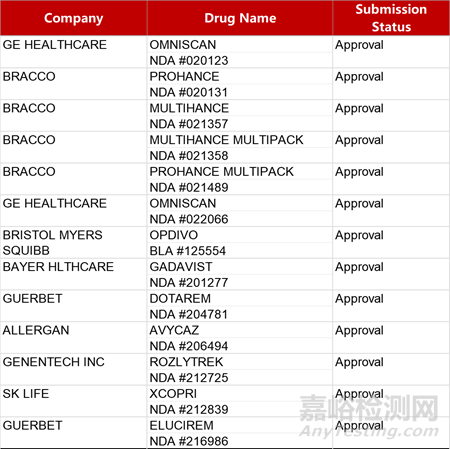
2. FDA新药获批情况(北美01月29日)