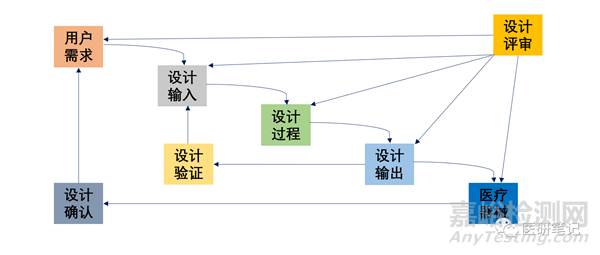
设计验证贯穿整个设计过程,工作中大家一直在用,但是做到完整性、科学性、合法合规性,以及经得起审评老师的挑战,就比较难了。
本篇就此展开讨论,希望对大家有所帮助。
NO.1 设计验证目的
1) 专业术语版
GB/T 42061-2022或ISO 13485:2016中的7.3.6规定,为确保设计输出满足设计输入的要求,应依据特定程序对设计进行验证。
该验证活动需要提供客观证据,可以是验证方案、验证报告或评审报告。
专业版说的比较抽象,晦涩难懂。
2) 通俗化版
设计验证要着眼于设计输出和设计输入之间关系的验证,看设计输出是否满足设计输入。
具体就是看设计输出的各项性能,是否满足要求。
满足要求,继续进行下一步。
不满足要求,需要返回上一步,进行修正或变更,如此反复。
3) 举例说明
设计输入要求产品的有效期是2年。
典型性样品已经制备完毕,如何验证?
可通过加速老化验证活动(即客观证据),评审老化后的测试结果,以判断有效期是否可以达到2年。
NO.2 设计验证方案
验证活动必须按照规定的程序进行,应制定验证方案。
可包括:
1) 方案设计的目的和范围:明确指出是哪一个阶段的验证方案。
2) 拟采用的验证方法:根据具体过程,制定合适的方法。有时过程验证还需要考虑最坏的条件,比如温度的上限、下限等极端情况。
3) 确定验证的性能指标:根据该阶段设计目的,明确性能指标,比如尺寸指标、功能性指标、安全性指标等。
4) 确定接受标准:比如尺寸的正负公差,或根据GB/T 2828.1-2012制定检验水平和接收质量限(AQL)。
5) 拟验证的批次:有的阶段验证,需要进行至少3个批次的验证。
6) 验证所需的样本量:根据统计学方法制定样本量(若适用)。
NO.3 设计验证报告
按着方案,完成设计验证活动后,应撰写设计验证报告。
设计验证报告应包括“人、机、料、法、环、测”等几个方面:
1) 验证过程的参与人员:参与验证的所有人员,包括测试人员。
2) 验证过程用到机器:如设备、工装夹具、检测仪器等(早期的设计活动可能不涉及)。
3) 验证过程采用的原、辅料信息(早期的设计活动可能不涉及):如原材料名称、牌号、批号等。
4) 验证过程拟采用的方法:这里的方法多种多样,有简单的方法、有复杂的方法、有高度标准化的方法等。
简单的方法:比如,产品尺寸的验证,根据工程图检测一下尺寸即可。
复杂的方法:比如,产品清洗的验证,需要制定一整套严密的清洗方案,再检测各相关指标。
高度标准化的方法:比如,无菌医疗器械的灭菌验证(EO灭菌),需要根据GB 18279-2023 (ISO 11135:2014)严格制定验证方案和报告。
5) 验证过程的环境:医疗器械的生产环境至关重要,十万级环境,还是万级环境等。
6) 测试的方法:明确指标检测的方法,应确保结果的准确性、精密性和可重复性,若采用新的测试方法,该方法应该得到评估或验证。
7) 连接功能性验证:如果设计的医疗器械与其他器械连接或有接口,应当对这一性能进行验证。当进行这种连接时,应验证此连接满足设计要求。
8) 实施日期:验证的起始日期,日期是验证活动追溯的重要线索,是真实性的证明。
9) 验证结果:详细记录验证结果,需要保留原始数据。
10) 验证结论:根据接受准则和验证结果,判断本次验证活动的结论,通过或者不通过。
NO.4 注意事项
1) 验证方案和报告一定要得到批准,适当时,还应该有设计评审!
2) 验证活动的过程和结果一定要有记录、要有记录、要有记录!
没有记录的验证活动等于没做验证。
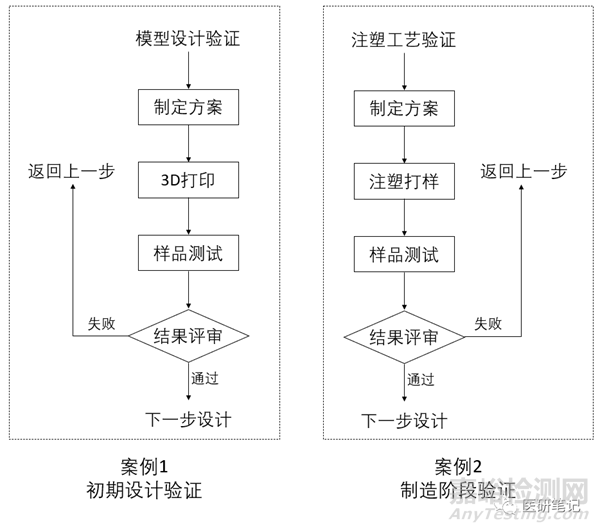
NO.5 验证活动案例
根据设计开发的初期阶段和制造阶段,列出了两个设计验证流程图,供对大家参考。
案例1:初期设计验证
案例2:制造阶段验证