1.DMS和QMS的实施背景
众所周知2019年12月1日史上最严的《药品管理法》开始实施,面对新形势新要求新标准,药品企业应以民众的健康为己任,以高科技、高品质的产品、热情周到的服务和无私的奉献精神,全心全意做好药。本文重点介绍如何在药企质量管理工作中注重诚信、关注品质,围绕质量管理的数字化转型开展工作,建立数字化文件管理系统和质量管理系统,着力打造药品制造全生命周期的数字化质量管控体系,确保药品质量安全有效。
2、DMS(文件管理系统)
2.1推进和应用
文件是质量管理系统的基本组成部分,必须使企业各项质量活动有法可依、有章可依,使行之有效的质量管理手段和方法制度化、法规化。企业通常文件数量庞大。在文件的约束和正确引导下,通过电子化质量系统文件的实施来保证质量体系的有效运行,从内至外可见完善文件管理的重要性和必要性。
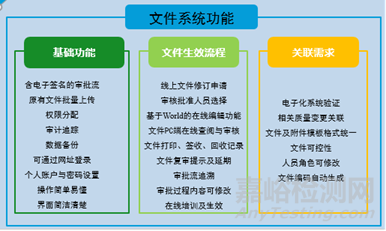
图1DMS文件系统功能建立亲和图
文件管理系统(DMS)依据GMP文件的整个生命周期进行合规管理。从文件创建/修订申请即开始介入,提供文件的模板管理、文件的在线编辑和在线审批、文件生效和撤销等流程化控制。充分参考了以下国内外法规文件,使得DMS能够100%符合质量法规要求:
l 良好自动化生产实践指南:遵从GxP计算机化系统监管的风险管理方法(ISPE GAMP 5)
l 现行药品生产管理规范(cGMP)
l 中国GMP(2010版)及附录《计算机化系统》、《确认与验证》
l CFR 21 Part 11 美国联邦法规21章第11款,电子记录与电子签名
l 欧盟GMP 附录11《计算机化系统》 (Computerized System)
l 欧盟2015年版《数据完整性指南》(MHRA GxP Data Integrity Definitions and Guidance for Industry)
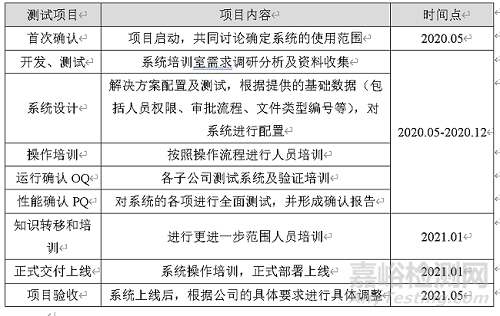
表1 测试流程与时间节点
文件管理根据文件管理规程中的文件生效流程而100%配对的电子化流程,并要求固定文件正文与附件模板,提高了文件的整体性,降低了文件因格式问题而退回的修改率和修改时间。在授权管理中加强了对文件培训的管控,避免了未培训的文件即生效的现象,由授权的文件管理人员负责对相关人员进行培训工作,并在文件系统上生成电子培训记录,代替以往纸质培训文件,使培训记录完整有效,培训完成后最终由授权人员进行确认。
2023年通过进一步优化了文件管理系统的文件保密权限,将已生效文件升版,增加了文件保密属性设置,确保电子文件符合GMP管理要求,实现100%严格受控。
2.2实施效果
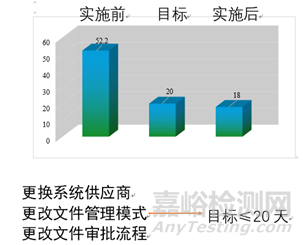
DMS文件系统的电子化上线,使企业各项质量活动有法可依、有章可依,使行之有效的质量管理手段和方法制度化、法规化。在文件的约束和正确引导下,通过质量系统文件的实施来保证质量体系的有效运行。DMS上线之后文件生效时长由原来的52天缩短为现在的18天。我公司的文件格式出错率解决97%;审核时长降低为之前的47.4%;生效时长降低为之前的39.5%;符合GMP文件管理要求;文件管理更安全稳定。
图2 文件管理系统实施效果
3、QMS(质量管理系统)
3.1推进和应用
质量管理系统QMS涵盖质量策划、生产现场质量控制、质量保障以及辅助实验室的质量控制流程,提升质量管控效率,同时引入SPC、FEMA等质量管理工具,辅助精准、高效质量控制。目前我司QMS上线偏差、变更、CAPA三个质量体系管理模块,将质量管理各环节的追溯关联,拉通各环节数字断点,实现线上质量预测、质量分析和质量追溯,不断提升数据完整性。三个流程集成到一个平台,统一管理,通过整合相关的事件和步骤、自动化工作流、趋势分析和报表图表功能等,帮助企业提高质量管理效率。
图3 QMS 运行界面
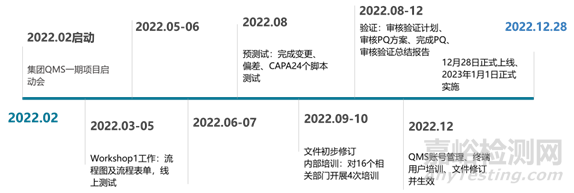
下面重点介绍三个质量流程:变更、偏差、CAPA,对其中的流程进行了反复测试和优化。对验证计划进行审核,与第三方提出需求。在正式验证开始前,根据脚本对流程进行预测试,为了使QMS用户提前了解系统并熟悉其界面和操作,我们提前对公司内部相关人员进行QMS流程及操作培训,共进行4场培训,涉及15个部门培训部门。后续确认我司确定需要的账号信息,组织第三方对所有相关人员进行了终端用户培训,完成对相关文件的修订、审核、培训工作。
图4 QMS测试流程与时间节点
QMS于2023年正式实施后,系统运行平稳,除及时解答用户问题并开展针对性培训外,也及时记录在使用过程中系统需优化的模块。具体情况如下:
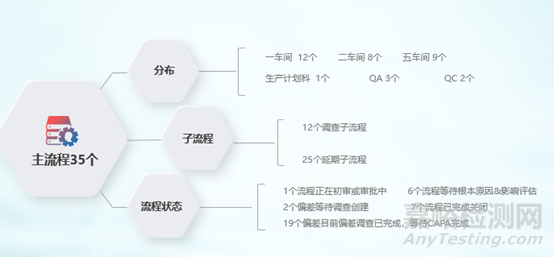
(1)偏差模块上线情况:
图5 QMS偏差流程运行
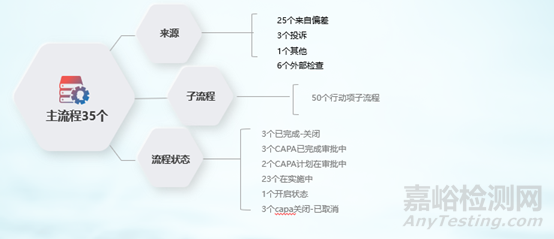
(2)CAPA模块上线情况:
图6 QMSCAPA流程运行
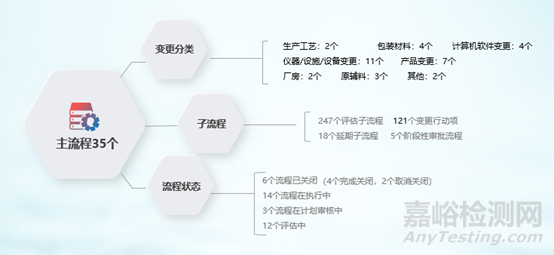
(3)变更模块上线情况:
图7 QMS 变更流程运行
QMS系统中变更、偏差、CAPA流程的处理与纸质流程对比,系统上的职责分工更加明确,具有邮件提醒功能,流程间可相互关联,显著提高了流程处理效率。
3.2实施效果
(1)QMS整合并规范药品全生命周期质量管理活动的系统,实现全面管理。将离散的孤立流程,分散的独立系统进行流程内核流程间的整合和连接。
图8 QMS实现流程内整合
图9 QMS实现流程间整合
(2)QMS实现全面电子化管理,无纸化效率迅速提升
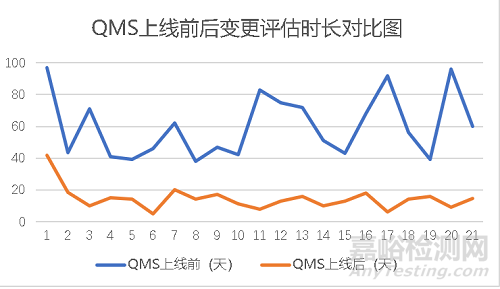
QMS质量管理系统通过设置行动项完成时间与增加提醒措施可以有效地降低变更评估时长与变更实施时长,从而起到降低变更流程完成时间的目的。变更流程平均完成时长降低为之前的47.8%,大大提高了变更流程效率,节省人力与时间成本。且信息化的手段能更好的对应GMP合规,使数据可靠性增强,质量体系要求提高。
图10 QMS变更流程实施效果
4、总结
(1)通过DMS和QMS的上线使用,药企的药品质量的管理能力进一步提升。
药品制造数字化转型的变革,带来的是整体质量管理能力和人员质量意识的提升。为了保障药品制造全生命流程的合规性以及满足法律法规的严谨性,硬件设施的合理选型、全面规划部署和软件完整性及可追溯性的合规性验证工作,两者缺一不可。质量部门协同合作,针对数字化转型工作规范地、严谨地、有序地完成了各项工作。不仅软硬件的质量管理更为合理、合规,同时培养了一批拥有质量管理以及计算机系统应用的复合型人才,为全面质量管理建设,提供了强大源动力。
(2)通过DMS和QMS的上线使用,药品质量风险管控的能力进一步提升。
只要有流程的地方,就存在质量风险。DMS和QMS系统,实现了全流程文件、数据参数的及时、真实、连续和可追溯,将各项风险降至了最低,这为质量体系优化提供了强大的支撑。
(3)通过DMS和QMS的上线使用,质量管理效率的进一步提升。
药品制造的数字化转型,帮助企业打破传统,重塑高质量管理流程。无纸化操作下数据信息的传递效率达到了以往传统模式下难以企及的高度,数字化转型使药品制造全生命周期流程更为快速、便捷和透明。