一、概述
质量标准是监管机构管理上市后药品的重要依据,作为药品获批时的重要附件与药品批准文号一并核发给企业,所以质量标准对监管机构及企业均非常重要。
笔者结合自己的工作经验,对化学药品制剂质量标准中通用项的书写规范进行梳理,以期对各位同仁有一定的借鉴意义。
二、质量标准书写规范
近期,笔者正在学习《国家药品标准工作手册》,结合学习内容及工作经验浅谈质量标准书写规范。总体上,质量标准要按照现行版中国药典的书写体例进行规范书写。笔者对质量标准中的通用项书写规范进行梳理,并结合案例与大家分享其书写规范。
(一)制剂质量标准书写规范
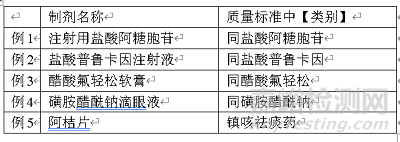
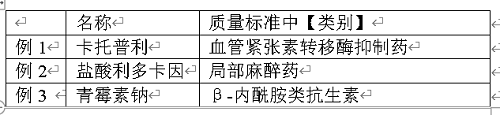
类别
单味制剂的“类别”,如果在相应原料药中已有收载,并与原料药完全相同时,可书写为“同XXXX(原料药名)”(如例1~4)。而复方制剂则应将类别全部写出(如例5)。
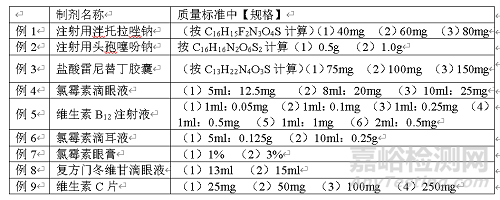
规格
制剂的规格是指每一制剂单位中(如每支、每片)含有主药的标示量(或效价)、含量(%)或装量。规格表述应清晰简洁,准确反映主药在制剂中的含量。如按有效部分计算时,一般应以分子式表示,而不用中文名,并应与其含量限度项下相呼应(例1~3);其中液体制剂还应注明每支的容量(例4~6);多剂量的制剂也可用浓度%表示(例7)。列有“处方”或在含量限度中已表明规格的制剂,可免列“规格”,列有“处方”或标有浓度的制剂,也可同时规定装量规格(例8)。
产品规格在0.1g以下的用“mg”为单位,0.1g以上的用“g”为单位;但如同时存在于一个制剂项下,则应统一用一种单位表示,即小的规格如用“mg”表示,超过0.1g的较大规格也采用“mg”为单位(例3、9)。
一个制剂有多个规格时,一般从量小的到量大,依次排列(例1、2、4~9)。
书写格式举例如下表所示:
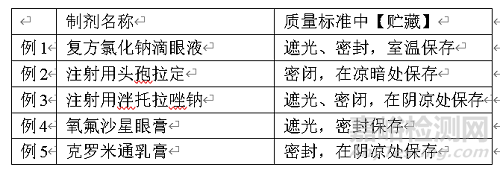
贮藏
贮藏条件系为避免污染和降解而对药品贮存与保管的基本要求,应根据稳定性试验结果制定,仿制药的贮藏条件原则上参照参比制剂制定。贮藏条件一般按照光照、包装状态、温度、湿度(如涉及)和特殊注意事项(如涉及)要求顺序列出,如“避光,密封,不超过25℃保存”。
贮藏项下的规定是对药品贮存与保管的基本要求,由于分装注射液的安瓿、注射用粉针剂的分装容器(如管制抗生素瓶)、分装眼膏的灭菌容器和分装滴眼液的容器均直接接触药品,可视为该制剂的组成部分,不同于片剂或其他制剂的包装容器(玻璃或塑料容器),因而在贮藏项下对包装的要求,可写为“密闭保存”等,而不用“熔封”或“严封”。片剂或其他制剂贮存条件,可根据药品的性质与制剂通则有关规定拟定贮藏条件。
书写格式举例如下表所示:
(二)原料药质量标准书写规范
类别
系按药品的主要作用、主要用途或学科划分,列出药品主要的、成熟的类别。
书写格式举例如下:
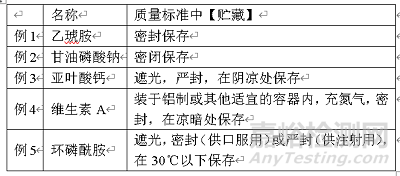
叙述对药品包装与贮藏的基本要求。应根据药品“性状”下的描述并结合稳定性,选择合适的条件,以避免或减缓药品正常贮存期内的变质;有关贮藏的专用名词的定义,在《中国药典》“凡例”中已有叙述。书写原则如下:贮藏
(1)一般原料药均应写“密封保存”。
(2)不易吸潮、风化,无挥发性,遇湿不会引起变质,稳定性好的原料药可写“密闭保存”。
(3)供直接制备成注射用无菌粉末的原料药,以及需要减压或充氮保存的药品,用“严封(或熔封)保存”。
(4)必要时,可在前面加“遮光”(遇光易变质)、“充氮”(遇空气易氧化变质)或“置耐压钢瓶内”(气体药品)等字样。
(5)个别品种对温度与湿度有特殊要求的,可在“密闭(或密封)”与“保存”之间,增加对贮藏场所的要求。如:“在干燥处”、“在阴凉处”、“在冷处”、或“在XX℃以下”;由于冷处系指2~10℃,要求条件较高,选用时应慎重。
书写格式举例如下表所示:
三、质量标准书写中的其他注意事项
【有效期】依据现有的稳定性数据拟定,有效期应以月为单位描述,一般为6个月的倍数,通常不低于12个月。同时应在制剂质量标准中增加【上市许可持有人】信息,在原料药质量标准中增加【生产企业】信息。
四、小结
质量标准作为药品上市后监管的重要依据,对保证药品质量至关重要,其重要性不言而喻。规范书写质量标准有利于更好地管理产品,希望本文能对业界同仁有一定的借鉴作用。
本文如有不对之处,欢迎指正。
五、参考文献
1、中国药典
2、国家药品标准工作手册
3、化学药品说明书及标签药学相关信息撰写指导原则(试行)