摘要:包衣微丸制剂具有掩盖药物的不良臭味、改善药物含量均匀性、提高药物稳定性与改变药物释放特性等特点,是当前仿制药研发及申报的热点。文章介绍了对包衣微丸的结构、制剂的处方组成以及包衣工艺的特点。结合生产现场检查中的常见问题,对仿制药申报中包衣微丸制剂的处方工艺及质量研究进行了分析和探讨。
微丸是直径1.0~2.5 mm 的小球状口服剂型,具有流动性好、延长药物的作用时间、减小胃黏膜刺激性、实现液态药物的固体剂型化、增强药物吸收全、提高生物利用度等作用[1]。微丸包衣的基本目的包括:掩味、着色;提高药物稳定性,如防潮、抗氧化、遮光、隔热等;改善药物含量均匀性;改变药物释放特性,实现缓控释目的[2]。每个微丸都是一个独立的递药单元,可作为多单元型给药系统的组成部分,一般以压片或填充入空胶囊的形式使用[3],是当前仿制药研发及申报的热点。
本研究主要讨论以空白丸芯为载体,采用流化床包衣技术进行载药的包衣微丸制剂。流化床包衣技术指将药物配成溶液或混悬液,利用热气流使待包衣物料在流化室内悬浮,并呈流化态,再喷入包衣液使其逐层、均匀地包裹在颗粒或微丸表面,直至达成所需载药量,形成载药微丸,最后通过衣膜的不同特性而使微丸具有不同的功能[4]。
一、包衣微丸的结构
包衣微丸一般由丸芯、载药层、缓释层或肠溶层构成。
部分药物在载药层内外分别增加隔离层,以物理性地避免主成分与丸芯或肠溶层相互接触;在某些情况下,隔离层还可作为扩散屏障阻止主成分或肠溶包衣组分的迁移。以拉唑类药物为例,其主成分对酸的稳定性较差,而肠溶包衣材料如丙烯酸树脂中含有很多酸性基团,故需要在载药层及肠溶层中间加入隔离层,以抑制主成分与肠溶层的相互作用[5]。
部分药物在微丸最外层还要增加保护层或修饰层。保护层或修饰层能使微丸更光滑,减少静电的产生,从而改善微丸贮存稳定性及机械加工性。如后续存在微丸压片工艺,增加保护层或修饰层后再压片,可降低微丸的破碎程度,使微丸型片与微丸的释放曲线相似性更高。如主成分对光敏感,在保护层或修饰层中加入遮光剂,还有利于提高制剂的稳定性。
例如,美国礼来公司申请的中国专利 1128141A[6]中提供了多种四基萘氧噻吩丙胺肠溶丸剂的处方,其中实例 11 的处方组成如表 1 所示。
二、包衣微丸制剂仿制药研发的药学特点
2.1 处方研究
2.1.1原料药
常见包衣微丸制剂的活性成分均为多晶型,不同的晶型不仅会影响原料药的粉体力学性质,同时也会造成药物释放与吸收的差异。微丸载药工艺多数采用将原料药溶于溶剂(可以是水性溶剂,也可以是有机溶剂)中,通过流化床包衣法载于空白丸芯表面。如载药溶液为真溶液,应考虑原料药溶解前与在丸芯上的析出物的晶型是否一致;如载药溶液为混悬液,应考虑载药溶液在溶液配制及上药过程中是否会发生晶型转变。
原料药的粒径常对药物释放产生重要影响,在包衣微丸制剂中,原料药的粒径还会影响载药微丸的层积上药率。在对原料药粒径进行研究筛选时,应考虑不同粒径原料药对包衣效率的影响。
2.1.2 丸芯[7]
成分:丸芯可由蔗糖、乳糖、淀粉、甘露醇、微晶纤维素等辅料制成。其中,微晶纤维素丸芯具有优良的弹性和黏性,在抗压性上具有优势。
粒径:为了提高各包衣层的均匀度及最终成品的均一性,应优选具有较窄粒度分布的丸芯。丸芯的粒径越小、比表面积越大,则制品中药物的释放速度越快;然而,这也会增加流化床包衣过程中工艺操作的难度,因为小粒径颗粒易产生粘连,同时可能影响物料混合的均一性。孟淑娟等[8]选择粒径为 106~212、150~300 及 300~500 μm 的微晶纤维素丸芯,分别进行上药包衣,包衣增重均为 6%。结果显示,106~212 μm 丸芯包衣后易出现微丸粘连的情况,出料后微丸破损,细粉较多;而 150~500 μm 丸芯的包衣产品在后续工艺过程中各项操作顺利,微丸也较圆整。
孔隙率:对压片工艺具有一定的影响,但主要影响微丸形变的程度及密度的增加程度,对微丸型片的释药行为影响不明显。
2.1.3 包衣材料[5]
肠溶包衣材料:常见的肠溶包衣材料有纤维素酯及其衍生物(邻苯二甲酸羟丙甲纤维素酯、HPMCAS 等)、聚乙烯醇醋酸苯二甲酸酯、甲基丙烯酸-甲基丙烯酸甲酯共聚物和虫胶等[9]。目前国内外应用较广泛的是丙烯酸树脂类高分子聚合物,具有安全、惰性、溶度快等优点。
增塑剂:可降低包衣材料的玻璃化转变温度,提高薄膜的柔韧性,有助于喷出的雾滴在丸芯表面铺展并相互结合以形成完整薄膜。常用的增塑剂有枸橼酸三乙酯、邻苯二甲酸二乙酯、枸橼酸三丁酯和癸二酸二丁酯等。
抗黏剂:当需要形成光滑表面、改善流动性、减少静电荷及防止颗粒大量聚集时,可以加入抗黏剂以改善包衣过程中颗粒聚集的情况。常用的抗黏剂有滑石粉、胶态二氧化硅、硬脂酸镁和单硬脂酸甘油酯等。
包衣微丸中药物的释放与稳定性等性能往往与辅料性能有密切关系。因此,应对辅料的功能性指标予以关注,如黏合剂与缓控释材料的黏度、大分子成膜材料的相对分子质量分布、抗黏剂的粒径等。黎炜烘[10]分别考察了乙基纤维素水分散 体 (Aquacoat ECD) 、 丙 烯 酸 乙 酯 - 甲 基 丙 烯 酸 甲 酯 共 聚 物 水 分 散 体(EudragitNE30D)、乙基纤维素混悬液(Surelease)和乙基纤维素 4 种缓释包衣材料以及 4%~12%的包衣增重对富马酸酮替芬缓释胶囊仿制药释放性能的影响,并与参比制剂进行比较。结果显示,不同包衣材料及包衣增重均对样品的释放曲线存在较大影响,采用 6%乙基纤维素混悬液制备微丸与参比制剂的释放曲线相似性较高。于佳[11]选择丙烯酸树脂 Eudragit RL 30D 和 Eudragit RS 30D(比例分别为 50∶50、40∶60、30∶70、20∶80、10∶90、0∶100 )的混合包衣液对洛索洛芬钠载药丸芯包衣,包衣增重为 15%,考察所得缓释微丸在 pH 6.8 磷酸盐缓冲液中的累积释放度。结果显示,随着包衣液中 Eudragit RL 30D 的比例的增大,药物的释放速度逐渐加快,当缓释包衣材料 Eudragit RL 30D 和 Eudragit RS 30D的比例为 20∶80 时,释药速率较合理且释药完全。
2.2 工艺研究
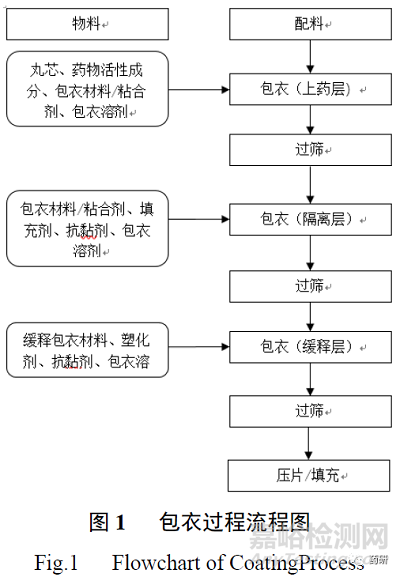
微丸的制备工艺可分为:①药物与辅料混合后直接制丸,如离心造粒法、挤出滚圆法;②以空白微丸为载体进行载药,常用方法为流化床喷雾层积载药[1]。常见多层包衣制备流程如图 1 所示。
2.2.1 包衣工艺[9,12—13]
进风量:流化设备主要利用热气流吹起微丸至一定高度,继而进行包衣。流化床进风流量对微丸的流化状态和包衣增重均有影响。鼓风流量过低时,微丸易粘连呈短棒形;而鼓风流量过高时,微丸运动过于激烈,易磨损,且不能与喷入的黏合剂充分接触,不利于造粒,制品多呈椭球形。因此,应通过充分调研工艺过程,选择适宜的进风流量。
进风温度:进风温度偏低时,包衣液成膜慢,且粘连现象严重;进风温度偏高时,聚合物黏性变大,会过早成膜,同时雾化的包衣液未到达微丸表面时就已被干燥成微粉,且所得微丸变脆,会因相互碰撞而破碎。
蠕动泵流速:蠕动泵流速主要对包衣效率、微丸粘连情况、微丸外观有影响。流速太小时,包衣需耗费较长时间,且时间过长会使包衣液中的有机溶媒挥发;流速太大时,包裹在丸芯上的雾化液滴来不及干燥,会出现微丸粘连现象。
雾化压力:流化床的喷嘴雾化压力对进风流量和包衣液的雾化程度都有影响。在进液速度不变的情况下,若雾化压力太小,则不能将进入流化床的液体雾化成均匀的小液滴,会造成液滴包裹在丸芯上来不及干燥而出现粘连现象,同时也会使衣膜包裹不均匀;若雾化压力太大,会将液体雾化成极小的液滴,在还未包裹到丸芯上时就已被干燥,使包衣增重降低。
熟化时间:熟化是指微丸衣膜静态的愈合老化过程,充分熟化有利于提高微丸的贮存稳定性和使用安全性。游国叶[12]研究了不同熟化处理时间(6、12、24 h)对微丸释放的影响。结果显示,熟化处理对微丸的贮存稳定性和安全性存在明显影响。
包衣液均匀性:当肠溶包衣材料以混悬液的形式进行包衣时,应确保其保持均匀状态,且避免聚合物出现附聚的现象。预防措施包括轻轻搅拌混悬液,以及确保混悬液在喷嘴涡流或管路中不处于静止状态;但也应避免剧烈搅拌导致产生泡沫。在使用 HPMCAS 作为肠溶包衣材料的情况下,中国专利 1128141A[6]报道可通过加入氨水的方式来使包衣液中聚合物溶解。
静电现象:微丸在包衣过程中极易产生静电而相互粘连,不利于包衣。静电现象可通过控制进风湿度得到改善;在处方中加入滑石粉,可通过减小丸芯表面的粗糙程度来减少静电。在工艺研究中应关注静电现象对制剂过程造成的影响。
包衣终点:微丸包衣工艺的终点控制一般采用固定包衣增重或固定包衣液用量 2 种方法。如采用前法,由于微丸体积较小,流化床包衣会导致一定的损耗,且包衣过程中还存在水分的引入与蒸发,导致包衣前后微丸平均质量的测量值存在偏差。为减小这些偏差,应对包衣各项参数,如投料量、进风量、进风温度、蠕动泵流速、雾化压力、微丸流化状态、物料温度等进行严格控制,以获得可接受的批间稳定性和可重现性。如采用后法,由于喷液过程中会发生包衣液损失,因此在工艺研究验证过程中应充分研究并验证,以评估管路残留、过滤不完全、容器吸附等风险因素是否会导致隔离层或活性成分层上药不完全[14]。
包衣为制备包衣微丸的关键工序。在包衣工艺研究过程中,应对载药层、隔离层、缓释层或肠溶层、保护层或修饰层的包衣效率与工艺可行性进行研究,考察各层包衣对药物释放的影响,通过处方工艺研究及多批次工艺验证来确定包衣增重范围或包衣液用量,设定每层包衣的合理控制范围。可在工艺验证中通过测定微丸中药物的释放行为来确定包衣增重的合理性。同时,应关注载药层的含量均匀性、物理隔离层的完整性与均匀性、肠溶层的耐酸性。何磊等[15]以喷液速度、雾化压力和进风温度作为 3 个自变量,以包衣效率和微丸粘连率作为因变量,通过三因素三水平 Box-Behnken 设计优化托吡酯缓释微丸的包衣工艺。经优化,包衣效率与微丸粘连率分别控制在(93.2±1.5)%和(2.2±0.2)%,且所得包衣缓释微丸在不同释放介质中的释放曲线与参比制剂相似。
2.2.2 混合工艺[16]
微丸压片前一般需加入其他辅料以保护微丸在压片过程中的完整性。由于微丸与其余外加物料在粒径与密度上的差异,可能导致物料混合不均匀或粉末分层现象。混合物料在转移或压片过程中受到振动,甚至是终混物在压片前的放置过程中发生微丸渗滤下沉,这些因素均可能引起粉末分层,导致压片不均匀。此外,混合时间过长、搅拌速度过于剧烈均有可能产生静电,从而引起物料的选择性聚集。选用粒径、密度、表面光洁度和表面能都与微丸相近的外加物料,有助于确保物料混合的均匀度。
2.2.3压片工艺[7]
压片压力主要影响片剂的硬度、脆碎度、崩解时间及微丸的释药行为。硬度、崩解时间会随压片压力的增大而增加。若压片压力过小,会造成片剂脆碎度不合格;若压片压力过大,会造成微丸易被压碎。因此,压片压力应根据微丸自身的性质与处方的组成来选择。
2.2.4 中间体与过程控制
微丸包衣工艺是一个复杂的连续过程,每步工序对制剂的关键质量属性均存在一定的影响,应制定完善的工艺过程控制及中间体控制标准,以确保成品质量的可控性与一致性。
对于关键工序,应考虑同时进行定性与定量的工艺控制,如干燥工序不仅要明确进风温度与持续时间等定性参数,同时要明确水分或干燥失重等工艺终点。
对各层包衣的中间体,需考虑水分或干燥失重、包衣增重、微丸粒径、释放曲线等质控指标。在肠溶微丸的中间体控制中,还需要考虑进行耐酸力检测。
2.3 质量研究
2.3.1检测方法的提取回收率
由于包衣微丸制剂通常在载药层外还需进行多层包衣,加之辅料干扰,在进行有关物质与含量检测时,往往需进行较复杂的前处理。前处理方法能否对活性成分与杂质进行有效提取,对检测结果存在较大影响。在进行方法学验证时,应对检测方法的提取回收率进行充分验证。
2.3.2体外释放度
肠溶微丸在进行体外释放试验时,一般要先在酸性介质中考察 2 h,再更换缓冲盐介质进行测定。更换介质时通常要将转篮提起,此操作会使装有药丸的转篮在空气中暴露。《美国药典》(USP)通则<711>中提醒,对于缓释制剂,更换介质与调整 pH 值的操作应在 5 min 内完成,以免对样品批与批之间溶出行为的一致性造成影响。仿制药在多种介质中的释放曲线应与参比制剂相似。
2.3.3 剂量倾泄试验
部分包衣微丸缓释制剂的药品说明书中并未对是否允许饮酒的情况进行详细说明,可参考《调释制剂的药代动力学和临床研究指导原则(Guideline on thePharmacokinetic and Clinical Evaluation of Modified Release Dosage Forms)》、《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》等相关指导原则中含酒精饮料对调释制剂影响的相关要求,结合药物的临床使用情况,研究药物在含不同浓度酒精溶媒中的释放情况,以评价制剂在体内酒精环境中出现药物突释的可能性。若仿制药和参比制剂均存在乙醇剂量倾泻情况,且无法避免,应明确仿制药的剂量倾泻风险通常应不高于参比制剂。根据体外试验结果,某些特定情况下可能需要进行药物与含酒精饮料同服的体内生物等效性研究。
2.3.4与给药方式相关的质量属性
由于微丸制剂给药方式的灵活性,对于与给药方式相关的质量属性应予以关注。如美国 FDA 公布的艾司奥美拉唑镁缓释胶囊个药指南[17]中提出了与鼻胃管给药方式相关的药学研究,包括粒度分布和沉降体积等。鼻胃管型号、插管部位及饲管远端位置、给予的药物剂型、粉碎处理方式、产品的粒径等均可能影响其生物利用度和生物等效性,这就要求仿制药在经鼻胃管途径给药时,应与参比制剂达到给药效果的一致性。可参考 FDA《Use of Liquids and/or Soft Foods asVehicles for Drug Administration: General Considerations for Selection and in vitroMethods for Product Quality Assessments Guidance for Industry》等相关指导原则进行研究。
三、生产现场检查中的常见问题
3.1 溶液配制状态
由于载药溶液的均匀性对于制剂的含量均匀性十分重要,因此载药溶液的配制状态十分关键。如为真溶液,原料药在溶剂中是否完全溶解;如为混悬型溶液,在整个载药层的包衣过程中如何维持液体系的均匀性:这些问题应予以关注。同时,包衣液是否按照处方量配制,是否按照正确的投料顺序操作,配制完成的包衣液是否有团聚现象、有无明显泡沫等,均为企业容易忽略的过程控制点。
部分品种在生产过程中存在包衣液暂存现象,但企业未对暂存时限与暂存条件进行相应考察,或考察项目仅包括普通的理化性质,未包括微生物指标,载药溶液未关注暂存时限内主成分在溶液体系中的含量均匀度变化情况。
3.2 包衣液的使用及损耗情况
由于包衣液组分不同,配制参数不同,不同品种包衣液的使用及损耗情况往往大不相同。采用固定包衣液用量作为包衣终点判别指标时,包衣液搅拌过程中若产生大量泡沫,或配液桶及管道内存在包衣液残留,就会造成包衣液损耗,使包衣工序达不到预定的处方量,也会导致批间处方用量不均衡、包衣状态不稳定。
3.3 物料的静电状态
微丸易产生静电,继而对各工序中物料的流动性产生影响。在压片或胶囊填充过程中,下料过程可因静电作用而不连续、不恒定,企业常通过在压片或填充设备上配备强制饲料装置来改善此问题,但相应的饲料参数往往未纳入申报工艺。
3.4 输入参数的准确性
制备微丸常需在同一流化床设备上进行多次包衣,重复多次的参数输入易造成操作上的混乱。此外,部分品种存在仪器输入参数与申报工艺中描述参数不完全对应的问题。例如,部分多功能流化床设备控制参数的流量设定为蠕动泵的转动速度,但这并不完全等同于包衣液流速;在流化床生产操作过程中,操作人员通过磅秤测定单位时间内包衣液的减少量来计算包衣液的流速。上述 2 个变量,设备参数“蠕动泵转速”与实际包衣液流速,可根据汇总与分析建立起对应关系。
四、总结与讨论
包衣微丸制剂常具有较复杂的处方组成及制剂工艺。原辅料的性能与包衣微丸中的药物释放与稳定性等关键质量属性存在密切关系,多层包衣工艺的各项参数设定及过程控制对成品质量及批间质量一致性均存在重要影响。同时,由于包衣微丸制剂工艺的复杂性、临床用药的灵活性,对其质量研究也提出了一些特殊要求。此类制剂在生产过程中发现的问题也相应较多。建议企业在仿制药研发及生产过程中关注药物的药学特点,拟定合理、可行的生产工艺及全面的质量控制标准,保障包衣微丸制剂的有效性、安全性、质量稳定性,以及与参比制剂的质量一致性。