随着真实世界研究(Real World Study,RWS)的关注度日益增加及其重要性愈发突出,各国政府和监管机构纷纷出台政策以规范和促进真实世界研究的发展。如何利用真实世界证据(Real World Evidence,RWE)评价药物的有效性和安全性,已成为全球相关监管机构、制药工业界和学术界共同关注且极具挑战性的问题。本文将对我国近几年发布的真实世界研究相关政策及指导原则进行梳理。
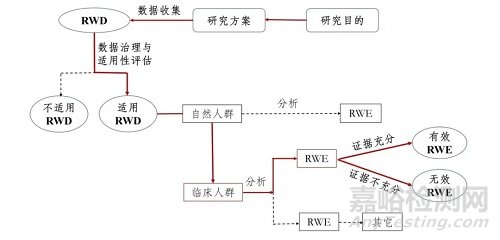
真实世界研究是针对临床研究问题,在真实世界环境下收集与研究对象健康状况和/或诊疗及保健有关的数据或基于这些数据衍生的汇总数据,通过分析,获得药物的使用价值及潜在获益-风险的临床证据的研究过程。简单来说,真实世界研究就是从真实世界数据(RWD)到真实世界证据(RWE)的一个过程。
图为支持药物监管决策的真实世界研究路径(实线所示)
来源:《真实世界证据支持药物研发与审评的指导原则(试行)》
我国真实世界研究相关政策及指导原则梳理
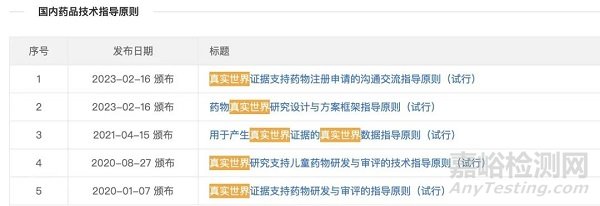
截至目前,国家药监局已发布5个真实世界研究相关指导原则。
以下为国家药品监督管理局药品审评中心网站查询数据:
1、2020年1月《真实世界证据支持药物研发与审评的指导原则(试行)》
2019 年 5 月,国家药品监督管理局发布了《关于公开征求〈真实世界证据支持药物研发的基本考虑〉意见的通知》,提出 RWE 可作为评价药物安全性和有效性的一种策略和路径。2020年1月,国家药品监督管理局(NMPA)发布“一号文”——《真实世界证据支持药物研发与审评的指导原则(试行)》,引发国内乃至全球医药学术、工业界的广泛关注。
本指导原则旨在厘清药物研发和监管决策中真实世界证据的相关定义,指导真实世界数据收集以及适用性评估,明确真实世界证据在药物监管决策中的地位和适用范围,探究真实世界证据的评价原则,为工业界和监管部门利用真实世界证据支持药物监管决策提供参考意见。
2、2020年8月《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》
2020年8月27日,国家药监局药审中心进一步发布关于《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》的通告(2020年第22号)。该指导原则指出,真实世界作为新研究方法中的一种,已逐步用于支持儿童药物的研发与审评,为新药注册、扩展儿童适应症、完善儿童剂量方案等提供支持。
3、2021年4月《用于产生真实世界证据的真实世界数据指导原则(试行)》
由于“一号文”中对于RWD的相关概念、来源、治理、评估方法等阐述并不详致,一定程度上影响了“一号文”在推动我国RWS发展所发挥的作用。2021年4月15日,国家药监局颁布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,是我国真实世界数据(RWD)领域又一重要文件。
该指导原则是《真实世界证据支持药物研发与审评的指导原则(试行)》的配套和补充,将从真实世界数据的定义、来源、评价、治理、标准、安全合规、质量保障、适用性等方面,对真实世界数据给出具体要求和指导性建议,以帮助申办者更好地进行数据治理,评估真实世界数据的适用性,为产生有效的真实世界证据做好充分准备。
4、2023年2月《药物真实世界研究设计与方案框架指导原则(试行)》
为了指导申办者科学合理地设计真实世界研究,明确真实世界研究方案撰写的技术要求,药审中心组织制定了《药物真实世界研究设计与方案框架指导原则(试行)》,于2023年2月16日发布,自发布之日起施行。
该指导原则曾于2022年7月7日发布《药物真实世界研究设计与方案框架指导原则(征求意见稿)》,该指导原则适用于通过真实世界研究获得药物评价的临床证据,也可供以非注册研究为目的的真实世界研究参考。重点阐述药物研发及评价中真实世界研究设计以及研究方案制订的基本考虑,为药物研发中开展真实世界研究提供指导意见。
5、2023年2月《真实世界证据支持药物注册申请的沟通交流指导原则(试行》
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,药审中心组织制定了《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》,于2023年2月16日发布,自发布之日起施行。
本指导原则在《药品注册管理办法》《药物研发与技术审评沟通交流管理办法》基础上,明确了使用真实世界证据支持注册申请时,沟通交流要讨论的核心问题、会议资料要求等,为申办者在关键时间节点开展沟通交流提供建议,以提升药物临床研发效率。适用于将真实世界证据作为有效性和/或安全性评价的关键证据来支持药物注册申请时的沟通交流,具体流程按照《药物研发与技术审评沟通交流管理办法》进行管理实施。
其他相关政策
1、2021年10月《中成药真实世界研究技术指导原则》
2021年10月25日,全国团体信息平台发布了由中国中药协会等组织起草的《中成药真实世界研究技术指导原则》(T/CATCM 011—2021)团体标准。该指导原则主要章节内容针对各种常见的真实世界研究方法,从研究立题、方法选择、数据收集、数据处理、统计分析、经济学评价等方面,结合中成药自身特点,进行了细致的阐述和科学指导,适用于我国基于真实世界数据的中成药有效性、安全性及经济性评价参考。
2、2022年4月《海南博鳌乐城国际医疗旅游先行区医疗器械临床真实世界数据应用试点品种沟通交流程序(试行)》
为有序推进海南博鳌乐城国际医疗旅游先行区医疗器械临床真实世界数据应用试点工作,促进海南博鳌乐城国际医疗旅游先行区更快更好发展,加强对医疗器械试点品种的早期介入和全程指导,进一步提高医疗器械试点品种沟通交流的质量和效率,国家药品监督管理局医疗器械技术审评中心会同海南省药品监督管理局联合制定《海南博鳌乐城国际医疗旅游先行区医疗器械临床真实世界数据应用试点品种沟通交流程序(试行)》,于2022年4月18日颁布。
3、2022年11月《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》
为进一步巩固总结应用试点工作经验,优化完善工作机制,强化沟通交流程序,国家药监局药审中心会同海南省药监局、乐城管理局联合修订了《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》,于2022年11月16日颁布,自发布之日起施行。
资料来源:
1.国家药品监督管理局.真实世界证据支持药物研发与审评的指导原则(试行).2020.
2.国家药品监督管理局、国家药品监督管理局药品审评中心、海南省药监局等网站.