您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-02-22 17:33
|
功能 |
成分及注射层次 |
|
|
填充材料 |
扩张组织容积 |
大分子透明质酸:真皮深层 |
|
填平褶皱、塑形 |
中分子透明质酸:真皮深层 |
|
|
补水美肤 |
小分子透明质酸:真皮浅层和表皮 |
|
|
补充材料 |
补充胶原 |
胶原蛋白:真皮层 |
|
刺激胶原再生 |
PLLA、PCL、PN/PDRN:真皮深层、筋膜层、骨膜 |
|
|
支撑材料 |
塑形、支撑轮廓,补充因骨质流失造成形态减损 |
骨性材料:真皮深层、皮下浅层、骨膜。 |
|
高交联大分子透明质酸 |
||
|
CaHA(Radiesse)、PMMA(爱贝芙)、PVA(宝尼达)、葡聚糖等 |
||
|
埋线提拉:真皮深层、皮下脂肪、筋膜层、肌肉层 |
||
|
萎缩材料 |
减缓皱纹 |
肉毒素:肌肉组织 |
|
消溶组织 |
溶脂针:脂肪组织 |
|
二、PLLA、PCL、PN/PDRN三者对比
|
童颜针 |
少女针 |
婴儿针 |
|
|
成分 |
PLLA聚左旋乳酸 |
PCL微球+CMC凝胶 |
PN/PDRN |
|
效果 |
填充,全面改善皮肤弹性、皮肤失水 |
“填充+修复”双重功效 |
修复受损细胞,并达到多重护理功效 |
|
维持时间及注射疗程 |
1-2年(3-4次/疗程,每次间隔4-6周) |
1-4年(需多次注射,不同产品型号不同) |
3-6个月(2-3次/疗程,每次间隔1-2个月) |
|
注射部位 |
用于面部(不适用眼睑、嘴唇)、身体多部位 |
面部填充(不适合注射眼睑、嘴唇等部位) |
全脸(眼周适用) |
|
注射层次 |
真皮深层以及皮下组织层、骨膜上层 |
注射层次较深,有些涉及到筋膜层、骨膜层 |
真皮浅层、深层 |
三、PN与PDRN对比
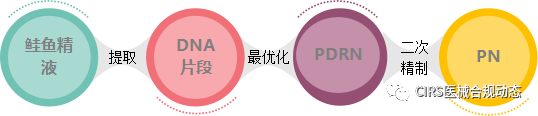
|
PDRN |
PN |
|
|
批准适应症 |
仅在处方上可用,不能作为非处方医疗设备提供;治疗迟钝的伤口和糖尿病足溃疡。 |
仅作为非处方医疗器械提供 |
|
注射方式 |
肌肉内给药 |
用于局部和皮内给药 |
|
医美类适应症 |
抗炎:缓解肌肤炎症,修复皮肤屏障 |
再生修复:激活皮肤再生力与修复力,长效PDRN。 |
|
分子量 |
350 |
1000 |
|
DNA长度 |
短 |
长 |
|
3D结构 |
无 |
有 |
四、PDRN&PN国内监管现状
此产品目前在欧盟和韩国取得相应医疗器械注册证,国内并无已批准的医疗器械注册证。此类产品作为医疗美容类医疗器械风险较高,国内按照三类器械监管,因此需要符合医疗器械监管法规,获得医疗器械注册证和生产许可之后方可进行生产销售。
|
品牌 |
国家 |
主要成分 |
持续时间 |
|
氐殊D+CELL |
韩国 |
PDRN |
1-3个月 |
|
普丽兰 |
韩国 |
PDRN |
1-3个月 |
|
丽驻兰 |
韩国 |
PN |
1-3个月 |
|
丽铂纳 |
韩国 |
PN |
1-3个月 |
|
露美婴儿针 |
韩国 |
PDRN |
1-3个月 |
|
Placentex |
意大利 |
PDRN |
1-3个月 |
|
MASTELLINEWEST |
意大利 |
PDRN |
1-3个月 |
|
Particolare铂金 |
中国 |
PDRN |
1-3个月 |
|
- |
欧盟 |
PN:III 类CE 0373 医疗器械 |
|
|
- |
中国 |
PDRN与透明质酸钠溶液混合界定为药械组合以医疗器械为主的产品 |
(1)三类医疗器械注册流程
依据《医疗器械监督管理条例》规定,第II、III类医疗器械施行注册管理,在投放中国市场前,应先向药品监督管理部门提交注册申请并获得医疗器械注册证。同时确保在医疗器械生产质量管理规范体系下开展研发及生产经营活动。
(2)三类医疗器械临床试验
临床试验是医疗器械临床评价过程中临床数据的主要来源,是为评价医疗器械安全性、临床性能或有效性而开展的系统性试验或研究,包括可行性试验、注册临床试验及上市后临床试验。医疗器械临床试验应符合《医疗器械临床试验质量管理规范》(也称为医疗器械GCP)要求,并在中国备案的医疗器械临床研究机构开展。
五、参考法规
|
序号 |
成分 |
法规名称 |
发布时间 |
|
1 |
透明质酸钠 |
国家药监局关于医用透明质酸钠产品管理类别的公告(2022年第103号) |
2022-11-14 |
|
《关于医用透明质酸钠产品管理类别的公告》(2022年第103号)解读 |
2022-11-14 |
||
|
透明质酸钠类面部注射填充材料临床试验指导原则(2019年第13号) |
2019-03-20 |
||
|
2 |
胶原蛋白 |
整形美容用重组人源化胶原蛋白注射材料技术审评要点(试行) |
2022-12-29 |
|
重组胶原蛋白创面敷料注册审查指导原则(征求意见稿) |
2023-01-26 |
||
|
YY/T 1888-2023《重组人源化胶原蛋白》 |
2023-01-18 |
||
|
3 |
PDRN |
《2022年第三次医疗器械分类界定结果汇总》 |
2022-10-27 |
|
4 |
药械组合 |
以医疗器械作用为主的药械组合产品注册审查指导原则 |
2022-01-11 |
|
以医疗器械作用为主的药械组合产品中药物定性定量及体外释放研究注册审查指导原则 |
2022-02-26 |
六、药监局已批准相关成分
|
序号 |
名称 |
具体成分及预期用途 |
|
透明质酸钠与羟丙基甲基纤维素复合的填充剂: |
||
|
1 |
医用羟丙基甲基纤维素-透明质酸钠溶液 |
由羟丙基甲基纤维素、透明质酸钠和平衡盐溶液组成的无菌凝胶状溶液。用于皮肤真皮深层至皮下浅层之间注射填充,以纠正额部皱纹和中重度鼻唇部皱纹。 |
|
2 |
医用透明质酸钠-羟丙基甲基纤维素凝胶 |
主要由交联透明质酸钠颗粒、羟丙基甲基纤维素、磷酸盐氯化钠缓冲溶液及注射用水组成。用于皮肤皮下浅层至深层之间的填充,以纠正中重度额部皱纹和中重度鼻唇沟皱纹。 |
|
以可吸收聚酯类材料制成微球并填加辅料制成的填充剂: |
||
|
3 |
聚乳酸面部填充剂 |
该产品为聚乳酸微球、甘露醇和羧甲基纤维素钠组成的冻干粉,使用前需经0.9%氯化钠注射液复溶为混悬液。适用于注射到真皮深层,以纠正中重度鼻唇沟皱纹。 |
|
4 |
注射用聚己内酯微球面部填充剂 |
由人工合成的聚己内酯(PCL)微球、甘油、羟甲基纤维素、磷酸盐缓冲溶液组成。用于皮下层植入,以纠正中到重度鼻唇沟皱纹。 |
|
5 |
含左旋乳酸-乙二醇共聚物微球的交联透明质酸钠凝胶 |
主要由交联透明质酸钠、左旋乳酸-乙二醇共聚物微球、盐酸利多卡因、磷酸盐缓冲体系组成。适用于真皮深层、皮下浅层及深层注射填充纠正中、重度鼻唇沟皱纹。 |
|
含不可降解成分的填充剂(即永久性填充剂): |
||
|
6 |
整形用胶原和PMMA皮下植入物系统 |
该产品为含聚甲基丙烯酸甲酯(PMMA)微球体的胶原蛋白悬浮液,含微量利多卡因。其中胶原蛋白来自澳大利亚的牛皮。装量为0.1ml的规格为过敏测试用的测试针,成分为牛胶原蛋白溶液。用于注射到真皮深层以纠正鼻唇沟纹,或填充到骨膜外层以进行(鼻骨段)隆鼻。其中的PMMA为不可降解成分。 |
|
7 |
医用含聚乙烯醇凝胶微球的透明质酸钠-羟丙基甲基纤维素凝胶 |
主要由透明质酸钠、羟丙基甲基纤维素、聚乙烯醇微球和平衡盐溶液组成。用于皮肤真皮深层及皮下浅层之间注射填充,以纠正中重度额部皱纹和中重度鼻唇部皱纹。其中的聚乙烯醇为不可降解成分。 |

来源:CIRS医械合规动态


