今日头条
两款国产新冠口服药获批上市。1月29日,国家药监局发布通知,附条件批准海南先声药业申报的1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、上海旺实生物申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。这两款药物均为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新冠病毒感染(COVID-19)的成年患者。患者应在医师指导下严格按说明书用药。
国内药讯
1.泽布替尼新适应症获FDA批准上市。百济神州新一代BTK抑制剂百悦泽®(泽布替尼)获FDA批准新适应症,用于治疗慢性淋巴细胞白血病(CLL)患者。在III期试验(SEQUOIA与ALPINE)中,无论是与苯达莫司汀联合利妥昔单抗相比用于一线CLL治疗,还是与伊布替尼相比用于R/R CLL治疗,百悦泽®均达到优效性,且心脏功能相关的不良事件发生率更低。
2.诺华CDK4/6抑制剂在华获批上市。诺华CDK4/6抑制剂琥珀酸瑞波西利片(凯丽隆)获国家药监局批准上市,与芳香化酶抑制剂联合用药,一线治疗HR+/HER2-局部晚期或转移性乳腺癌绝经前或围绝经期女性患者。Ⅲ期MONALEESA-7研究42个月的随访结果显示,该药物与标准内分泌疗法联用可显著延长患者总生存期(70%vs46%)。Kisqali是首个与内分泌疗法联用一线治疗晚期乳腺癌的靶向疗法。
3.贝达EGFR-TKI新适应症报产。贝达药业1类化药甲磺酸贝福替尼胶囊新适应症上市申请获CDE受理,推测适应症为一线治疗EGFR敏感突变非小细胞肺癌(NSCLC)患者。公布于ESMO Asia年会上的III期临床数据显示,甲磺酸贝福替尼对比埃克替尼(凯美纳®)作为EGFR敏感突变非小细胞肺癌患者一线治疗达到主要疗效终点,显著改善患者的无进展生存期(PFS)。
4.银诺GLP-1R激动剂Ⅲ期临床积极。银诺医药每周1次GLP-1R激动剂苏帕鲁肽用于治疗2型糖尿病的两项Ⅲ期临床(YN011-301、YN011-302)均达到主要终点。24周治疗数据显示,苏帕鲁肽(1mg和3mg)单药较安慰剂可使患者HbA1c水平下降至<7%的受试者比例更高,苏帕鲁肽两个剂量受试者HbA1c水平分别较基线下降1.73%和2.15%;当苏帕鲁肽(3mg)与二甲双胍联用时,患者平均HbA1c下降至<7%的受试者比例达到58%,显著高于安慰剂组(P<0.001)。此外,药物总体耐受性良好。
5.诺诚健华泛FGFR抑制剂Ⅱa期临床积极。诺诚健华泛FGFR抑制剂gunagratinib(ICP-192)在ASCO GI2023会议上公布用于治疗局部晚期或转移性的FGFR基因异常的胆管癌经治患者的Ⅱa期剂量扩展研究数据。Gunagratinib在17例患者中达到52.9%的总缓解率,疾病控制率为94.1%,中位无进展生存期为6.93个月(数据截止时尚未达到)。此外,药物的耐受性良好。在美国,FDA曾授予gunagratinib治疗胆管癌的孤儿药资格。
6.苏州同宜Bi-XDC获FDA批准临床。同宜医药宣布其第三款双配体偶联药物(Bi-XDC)CBP-1019获得FDA临床试验默示许可,并同日向CDE递交了IND申请。CBP-1019是该公司基于其BESTTM技术平台开发的新一代双配体小分子药物偶联体。在包括肺癌、卵巢癌、胰腺癌、食管癌和消化道癌的多个肿瘤模型中,CBP-1019均表现出积极的抑瘤效果和剂量相关性,且药物具有良好的安全性。
7.和黄医药「呋喹替尼」海外授权。和黄医药旗下和记黄埔医药(上海)与武田子公司就VEGFR抑制剂呋喹替尼达成独家许可协议,授予武田在中国大陆、香港及澳门地区以外的全球范围独家推进呋喹替尼(针对所有适应症)的开发、商业化和生产权益。根据协议,和记黄埔医药(上海)将可获得高达11.3亿美元的付款,其中包括协议成交时4亿美元的首付款和可高达7.3亿美元的潜在里程碑付款,以及产品的销售分成。
国际药讯
1.首款口服SERD获FDA批准上市。Menarini旗下公司Stemline开发的选择性雌激素受体降解剂(SERD)elacestrant(Orserdu)获FDA批准上市,用于治疗ER+/HER2-晚期或转移性乳腺癌。在Ⅲ期临床EMERALD中,与标准治疗相比,elacestrant用于二线或三线单药显著改善总体患者的无进和展生存期PFS(PFS率:22.3%vs9.4%),显著改善ESR1突变患者的PFS(PFS率:26.8%vs8.2%)。FDA同时也批准了Guardant360 CDx测定作为辅助诊断设备,用于识别乳腺癌患者接受elacestrant治疗。
2.FDA批准HER2抑制剂用于结直肠癌。Seagen公司HER2抑制剂Tukysa(tucatinib,妥卡替尼)获FDA加速批准新适应症,联合曲妥珠单抗二线治疗HER2阳性结直肠癌(mCRC)成人患者。在Ⅱ期MOUNTAINEER临床中,联合治疗达到38.1%的确定客观缓解(95% CI:27.7-49.3),中位DoR为12.4个月(95% CI:8.5-20.5),中位PFS为8.2个月(95% CI:4.2-10.3),中位OS为24.1个月(95% CI:20.3-36.7)。Tukysa也是FDA批准的首个靶向HER2结直肠癌疗法。
3.尘螨过敏免疫疗法获批用于青少年。FDA批准ALK公司舌下含片Odactra新适应症上市,用于治疗由室内尘螨(HDM)引起的过敏性鼻炎青少年(12-17岁)患者。临床数据显示,与安慰剂相比,Odactra使患者的平均鼻炎组合总分(TCRS)减少幅度达到22%(分数差异=-1.04,P<0.01),而且药物在孩童与青少年的安全性与在成人当中所观察到的一致。此前,该药物已被批准用于治疗HDM引起的18-65岁过敏性鼻炎患者。
4.首个CRISPR基因编辑疗法在欧盟报产。Vertex公司与CRISPR公司开发的自体CRISPR/Cas9基因编辑疗法exagamglogene autotemcel(exa-cel)的上市申请获欧洲EMA受理,用于治疗镰刀状细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)患者。两项临床数据显示,随访为1.2~37.2个月时,有42例(n=44)TDT患者不再依赖输血,其平均总血红蛋白水平超过11 g/dL;随访为2.0~32.3个月时,所有31例SCD患者均未出现血管闭塞性危象,平均胎儿血红蛋白占比40%。如果获批,exa-cel将成为全球首款CRISPR基因编辑疗法。
5.奥贝胆酸治疗NASH再报NDA。FDA受理Intercept公司FXR激动剂奥贝胆酸(OCA)重新递交的新药申请(NDA),用于治疗非酒精性脂肪性肝炎(NASH)引起的肝硬化前期伴有肝纤维化患者,PDUFA日期为明年6月22日。在III期临床中,奥贝胆酸较安慰剂使患者实现肝纤维化程度至少改善1级且NASH情况没有恶化的比例更高(22.4%vs9.6% p<0.0001)。如果获批,奥贝胆酸将成为首款NASH疗法。
6.Keytruda联合用药胆道癌Ⅲ期临床积极。默沙东PD-1单抗Keytruda(pembrolizumab)联合化疗一线治疗晚期或转移性胆道癌(BTC)的Ⅲ期临床(KEYNOTE-966)达到主要终点。与安慰剂联合化疗相比,Keytruda联合化疗显著改善患者总生存期(OS),药物的安全性与过去结果一致。详细结果将在医学会议上公布。据统计,晚期胆道癌5年生存率约为5%~15%。
7.FLNA靶向小分子新药治疗AD临床积极。Cassava Sciences公司靶向细丝蛋白A(FLNA)的口服小分子化合物simufilam,在治疗阿尔茨海默病的Ⅱ期临床结果积极。Simufilam旨在靶向结合FLNA以阻止Aβ42(β淀粉样蛋白片段)的信号传导,抑制过度磷酸化的tau蛋白的产生和炎性细胞因子的释放。12个月治疗数据显示,患者评估认知衰退的ADAS-Cog评分较基线显著改善的比例达到47%,ADAS-Cog评分平均降低4.7(±3.8)点,simufilam总体耐受性良好。
医药热点
1.遴选儿童用药可不受“一品两规”限制。国家卫健委日前印发《关于进一步加强儿童临床用药管理工作的通知》。《通知》指出,医疗机构要建立完善儿童用药遴选制度,开展儿科医疗服务的二级以上医疗机构成立儿童用药工作组,定期对本机构药品供应目录中儿童用药进行评估和调整。遴选儿童用药时,可不受“一品两规”和药品总品种数限制,进一步拓宽儿童用药范围。
2.美国或建议每年秋季接种一次新冠疫苗。FDA于23日宣布,可能会建议美国人在每年秋季接种一剂新冠疫苗,就像流感疫苗一样。为了简化疫苗构成和接种时间,该机构还建议停止使用原有的疫苗,只提供二价疫苗用于初次注射和加强针。这些建议令一些科学家感到意外。据悉,FDA所提议的计划几乎没有研究支持。
3.非洲马拉维霍乱疫情已致逾千人死亡。非洲内陆国家马拉维卫生部24日公布数据显示,自2022年3月该国暴发霍乱疫情以来,截至当日此轮疫情已累计致30621人感染,1002人死亡。24日新增霍乱病例626例,新增死亡病例12例,目前有1115人住院治疗。据悉,该国霍乱疫苗已用完。卫生部发言人阿德里安·奇库姆贝表示,马卫生部已与世界卫生组织接洽,寻求新一批疫苗援助。
评审动态
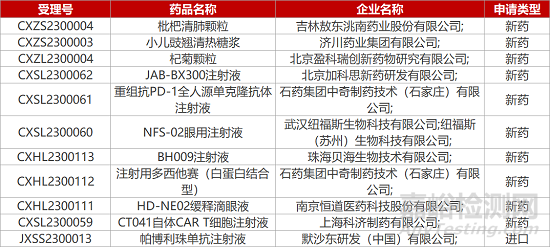
1. CDE新药受理情况(01月30日)
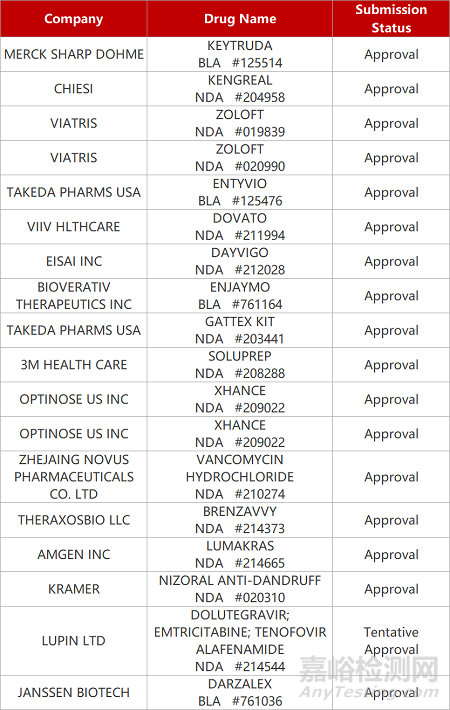
2. FDA新药获批情况(北美01月26日)