今日头条
君实新冠口服药头对头临床成功。君实生物核苷类抗新冠口服药VV116片(氘化氢溴化物瑞德西韦)与辉瑞Paxlovid(奈玛特韦片/利托那韦片)对比的Ⅲ期研究积极结果发表在《新英格兰医学杂志》上。有症状、轻中度新冠患者分别接受5天的VV116或Paxlovid治疗,主要终点为第28天持续临床康复的时间。数据显示,国产VV116非劣于Paxlovid(4天vs5天;风险比,1.17;95%置信区间,1.02~1.36),且不良事件发生率更少(67.4%vs77.3%)。
国内药讯
1.首个中药3.1类新药获批上市。康缘药业苓桂术甘颗粒获国家药监局批准上市,这是首个按古代经典名方目录管理的中药复方制剂,是首个中药3.1类新药。该药品处方来源于张仲景《金匮要略》,已列入《古代经典名方目录(第一批)》。苓桂术甘颗粒来源于古代经典名方苓桂术甘汤,由茯苓、桂枝、白术、甘草四味药组成。苓桂术甘汤为温化水湿的代表方,具有温阳化饮,健脾利湿功效。
2.基石阿伐替尼中国桥接研究见刊。基石药业与Blueprint公司合作的口服KIT/PDGFRα抑制剂阿伐替尼片(商品名:泰吉华),在The Oncologist杂志上发表用于治疗PDGFRA D842V突变、胃肠道间质瘤(GIST)的中国Ⅰ/Ⅱ期临床积极结果。数据显示,中心影像学(IRRC)及研究者评估的客观缓解率(ORR)分别为75%和79%,临床获益率(CBR)均为86%,12个月的总生存率达到92%;临床中未发现新的安全信号。
3.迈威CD47/PD-L1双抗获批新临床。迈威生物1类生物制品6MW3211注射液获国家药监局批准一项新适应症临床许可,拟用于恶性血液病的治疗。6MW3211是一款重组人源化抗CD47/PD-L1双特异性抗体,可同时阻断PD-L1/PD-1和CD47/SIRPα两条免疫抑制信号通路,实现T细胞和巨噬细胞联合抗肿瘤作用。目前该新药正处于Ⅱ期临床开发阶段,适应症包括复发/难治淋巴瘤、晚期透明细胞型肾细胞癌和晚期肺癌。
4.英诺湖CD40单抗获批临床。英诺湖医药1类生物制品ILB-2101注射液获国家药监局临床试验默示许可,拟用于晚期恶性肿瘤的治疗。ILB-2101是一款靶向CD40的全人源化IgG2激动型抗体,弱化了其CDC和ADCC作用,具有较同类抗体更强的药理学活性和更低的细胞因子释放风险。在小鼠荷瘤模型中,ILB-2101单药或联合PD-1抗体等免疫检查点抑制剂,均显示出积极的抗肿瘤活性。
5.石药CDK2/4/6抑制剂获批临床。石药集团1类化药SYH2043片获国家药监局临床试验默示许可,拟开发用于晚期恶性肿瘤的治疗。SYH2043是一款口服小分子CDK2/4/6抑制剂,已在临床前研究中显示出对多种实体瘤具有较好的抗肿瘤作用,尤其是对CDK4/6抑制剂原发耐药和获得性耐药的乳腺癌;临床前药代动力学及安全性评价也显示该产品具有良好的成药性和可控的安全性
6.永泰CD19/TGF-β靶向CAR-T报IND。永泰生物自主研发的1类生物制品迪诺仑赛注射液的临床试验申请获CDE受理,拟用于治疗复发难治性弥漫大B细胞淋巴瘤(r/r DLBCL)。迪诺仑赛注射液(RC19D2)是一款同时靶向CD19和TGF-β的CAR-T疗法,具备识别和杀伤表达CD19分子靶细胞能力并拮抗TGF-β信号的功能,可延长体内CAR-T细胞存活时间并促进CAR-T细胞浸润。这也是永泰生物第二款进入临床的CAR-T疗法。
7.时迈EGFR/CD3双抗报IND。时迈药业1类生物制品注射用SMET12的临床申请获NMPA受理。SMET12是该公司自主研发的、可直接静脉滴注的EGFR/CD3双抗,该新药目前正在I期临床中评估用于治疗表皮生长因子受体(EGFR)阳性晚期实体瘤患者的药代动力学特征和安全性。临床前研究显示,SMET12在体内的抑瘤率达90%以上,且耐受性良好,细胞因子风暴风险低,预期临床应用安全可靠。
国际药讯
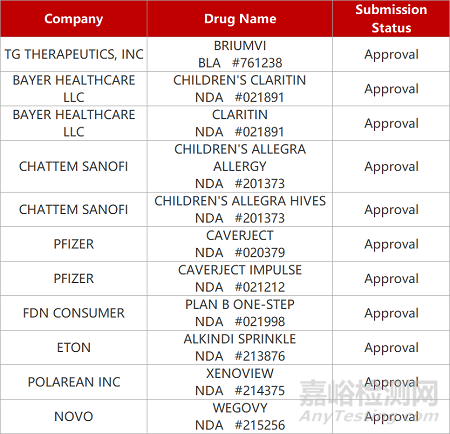
1.创新CD20单抗获FDA批准治疗RMS。TG Therapeutics公司创新糖工程化抗CD20抗体Briumvi(ublituximab)获FDA批准上市,用于治疗复发性多发性硬化(RMS)患者。这也是FDA今年批准的第36款创新药。Briumvi在两项Ⅲ期临床中均达到主要终点指标,与活性对照组相比,两项试验ublituximab治疗组患者年复发率显著下降(0.08vs0.19,p<0.001;0.09vs0.18,p=0.002)。
2.印度巴拉特新冠鼻内疫苗获批上市。印度巴拉特生物宣布与美国圣路易斯华盛顿大学合作开发的重组腺病毒鼻腔新冠疫苗iNCOVACC已获得印度药监部门批准上市,拟通过滴鼻方式,用于18岁以上人群的2剂加强接种,以及异源加强免疫。该公司同时透露,iNCOVACC即将在明年1月底上市销售,私人市场成本为800卢比(67.2人民币),政府成本为325卢比(27.3人民币)。
3.辉瑞五价脑膜炎球菌疫苗报BLA。辉瑞五价脑膜炎球菌候选疫苗MenABCWY的生物制品许可申请(BLA)获FDA受理,用于预防10至25岁人群中最常见血清群引起的脑膜炎球菌病。FDA预计将于明年10月做出审批决定。在关键Ⅲ期临床中,接受2剂MenABCWY与接受对照组疫苗(2剂Trumenba+1剂Menveo)的受试者在所有5个血清型中的免疫反应皆呈非劣效性。与单剂Menveo相比,单剂MenABCWY在对A、C、W、Y血清型的免疫反应上亦呈现非劣效性。
4.SpringWorks硬纤维瘤孤儿药向FDA报NDA。SpringWorks公司宣布已完成向FDA提交口服特异性γ-分泌酶抑制剂Nirogacestat的新药申请 (NDA),用于治疗成人硬纤维瘤。在Ⅲ期临床中,与安慰剂相比,nirogacestat显著改善患者的无进展生存期(HR=0.29(95% CI: 0.15, 0.55),p<0.001),将患者疾病进展风险降低71%;而且总体耐受性良好。此前,该新药已获得FDA治疗硬纤维瘤和EMA治疗软组织肉瘤的孤儿药资格。
医药热点
1.国家医学中心管理办法印发。12月29日,国家卫健委印发《国家医学中心管理办法(试行)》和《国家区域医疗中心管理办法(试行)》,进一步加强对国家医学中心和国家区域医疗中心的管理,推动双中心发挥积极作用。其中,《国家医学中心管理办法(试行)》明确主管部门对设置的国家医学中心进行年度考核,并确定了考核形式、考核内容以及根据考核结果建立动态调整机制的具体要求。
2.深圳首例仿生型人工心脏手术成功。香港大学深圳医院心血管医学中心魏民新教授心脏大血管外科团队,联合体外循环、麻醉、影像等多学科团队通力合作,成功为心脏重症患者丘先生(化名)进行左心室辅助装置(LVAD)植入手术(亦称“人工心脏”手术)。该项医疗技术的成功开展,标志着香港大学深圳医院心血管医学中心开启了心衰患者全疗程、全年龄段、高水平“一站式”治疗的新篇章。
3.西安市基层首家MMC中心正式授牌。日前,2022年国家标准化代谢性疾病管理中心(MMC)授牌仪式在江苏常州举办,通用技术环球医疗碑林区太乙路第二社区卫生服务中心被授予MMC医院,这标志着西安市基层医疗卫生机构首家MMC中心正式揭牌运行。该中心开设有诊疗室、检查室和健康教育室,配备有先进设备,包括下肢动脉硬化、眼底照相仪、骨密度仪、肌电图等,可为糖尿病及慢性并发症等代谢性疾病患者提供一站式服务。
评审动态
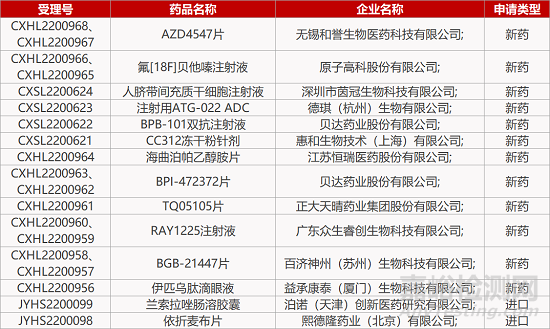
1. CDE新药受理情况(12月29日)
2. FDA新药获批情况(北美12月28日)