今日头条
赛生GD2单抗获批用于神经母细胞瘤。赛生药业与Y-mAbs Therapeutics合作开发的那西妥单抗(naxitamab-gqgk,Danyelza)获国家药监局批准上市,用于治疗复发性或难治性高危神经母细胞瘤患者。那昔妥单抗是一款GD2单抗,通过与肿瘤细胞表面的GD2结合,能够引起抗体介导的细胞毒性反应并激活补体系统,从而达到杀伤肿瘤的效果。2020年11月,FDA已加速批准那昔妥单抗上市。
国内药讯
1.晖致HIV三合一复方国内获批上市。晖致医药申报的5.1类新药依非米替片(I)获国家药监局批准上市,用于治疗成人和体重至少35kg儿童患者中的1型人免疫缺陷病毒(HIV-1)感染。这是Mylan公司开发的一款三联组合疗法,每片含有依非韦伦400mg、拉米夫定300mg及富马酸替诺福韦二吡呋酯300mg,已在海外获批上市,商品名为Symfi Lo,用于治疗成人和儿童HIV-1感染者。
2.绿叶抗抑郁症1类新药Ⅲ期临床积极。绿叶制药将在BESETO会议上公布盐酸托鲁地文拉法辛缓释片(LY03005)用于治疗抑郁症的Ⅲ期临床研究结果。与安慰剂相比,LY03005组第八周时患者的蒙哥马利-艾斯伯格抑郁量表(MADRS)、17项汉密尔顿抑郁量表(HAM-D17)和汉密尔顿焦虑量表(HAM-A)的评分较基线的变化均具显著性改善。药物的耐受性良好,不引发嗜睡,不影响性功能、体重和脂代谢。
3.和誉FGFR抑制剂尿路上皮癌II期临床积极。和誉医药泛FGFR抑制剂Fexagratinib治疗尿路上皮癌中国患者的II期临床结果积极。大部分伴有FGFR3变异的转移性尿路上皮癌患者出现肿瘤缩小,约30.7% (4/13)的患者达到独立评审委员会确认的部分缓解;在伴有FGFR3突变的癌患者中观察到更好的缓解率(44%,4/9)。药物总体耐受性良好,在美国,Fexagratinib已获得FDA授予的针对胃癌治疗的孤儿药认定。
4.加科思KRAS抑制剂拟纳入突破性治疗品种。加科思1类新药JAB-21822获CDE拟纳入突破性治疗品种,拟用于治疗既往至少一种系统治疗(至多不超过三线治疗)的携带KRAS p. G12C突变的局部晚期或转移性非小细胞肺癌患者。JAB-21822是一种KRAS p. G12C共价抑制剂,加科思正在中国、美国及欧洲同步临床开发。在Ⅰ期临床中,JAB-21822达到客观缓解率为56.3%,疾病控制率为90.6%。
5.石药新冠口服3CL蛋白酶抑制剂获批临床。石药集团宣布抗新冠病毒口服小分子3CL蛋白酶抑制剂SYH2055获国家药监局批准,将在中国开展临床试验。SYH2055是一款拥有全球自主知识产权的口服小分子1类新药,旨在通过作用于新冠病毒主蛋白酶抑制病毒前体蛋白的切割,进而阻断病毒复制并发挥抗新冠病毒的作用。该产品有望克服奈玛特韦必须与利托那韦联用的缺陷,覆盖更多患者群体。
国际药讯
1.全球首款逆转扩瞳眼科新药报NDA。Ocuphire公司已向FDA提交其含有0.75%的酚妥拉明滴眼液Nyxol的新药申请 (NDA),用于逆转由肾上腺素能激动剂(例如去氧肾上腺素)或副交感神经阻滞剂(例如托吡卡胺)或其组合引起的扩瞳。Nyxol可通过特异性阻断仅在虹膜扩张肌上表达的α1受体来调节瞳孔大小。来自MIRA-2和MIRA-3研究结果显示,与安慰剂相比,Nyxol在90分钟内使患者瞳孔直径恢复至基线水平(≤0.2mm)的比例更高(49%vs6%,58%vs7%)。
2.第一三共HER2-ADC临床最新数据积极。阿斯利康与第一三共开发的HER2-ADC新药Enhertu(trastuzumab deruxtecan)在既往接受曲妥珠单抗和紫杉烷治疗的HER2阳性不可切除/转移性乳腺癌的Ⅲ期临床(DESTINY-Breast03)结果积极。与活性对照组相比,Enhertu降低36%的死亡风险(HR:0.64,CI:0.47-0.87,p=0.0037);第2年时,两组预估生存率分别为77.4%与69.9%。详细数据公布在SABCS2022大会上,并同时发布于《柳叶刀》上。
3.抑郁症速效鼻喷剂获FDA快速通道认定。Vistagen公司靶向鼻化学感觉受体细胞的神经活性类固醇喷雾剂PH10获FDA授予快速通道资格,用于鼻内给药治疗重度抑郁症(MDD)。在为期8周的IIa期临床中,6.4μg PH10每日两次鼻内给药在一周内就能使患者汉密尔顿抑郁量表(HAM-D-17)评分显著改善;而且PH10起效快速、副作用极小。
4.TL1A单抗炎症性肠病Ⅱ期临床数据积极。Prometheus Biosciences公司潜在“first-in-class”抗TL1A单抗PRA023,在治疗溃疡性结肠炎(UC)和克罗恩病(CD)的两项Ⅱ期临床结果积极。在治疗中重度UC的试验中,PRA023治疗组12周时达到临床缓解的患者比例为26.5%(对照组为1.5%,p<0.0001))。在治疗中重度活动性CD的试验中,PRA023组中26.0%获得内镜缓解,与历史安慰剂组缓解率(12%)相比具统计学意义(p=0.002)。药物总体耐受性良好。
5.eIF2B激动剂渐冻人症早期临床积极。Denali公司eIF2B激动剂DNL343治疗肌萎缩侧索硬化(ALS)的Ⅰb期临床结果积极。DNL343旨在通过抑制ISR通路,预防或减缓与应激颗粒形成和TDP-43聚集相关的疾病进展。中期结果显示,DNL343在血浆中呈剂量依赖性增加;脑脊液中药物与血浆中未结合药物的平均比例在1.02-1.23之间,表明DNL343能穿过BBB进入到中枢神经系统中;ISR通路生物标志物(ATF4和CHAC1)的衰减,显示DNL343对该通路的强烈抑制作用。此外,患者的耐受性良好。
6.改良型细胞疗法低剂量早期临床积极。Achilles公司在ESMO IO2022大会上公布新抗原反应性T细胞(cNeT)治疗晚期不可切除或转移性非小细胞肺癌(NSCLC)和黑色素瘤的两项Ⅰ/Ⅱa期临床(CHIRON和THETIS)的中期更新数据。在NSCLC患者中,使用小剂量的cNeT、低剂量的淋巴细胞清除及IL-2治疗后实现部分缓解和疾病稳定;12周时达到71%的临床缓解率。在黑色素瘤患者组中,有50%的黑色素瘤患者(3/6)病情稳定。cNeT治疗的安全性良好。
医药热点
1.最大程度保障就医安全有序。12月7日,国务院联防联控机制综合组印发《关于进一步优化就医流程做好当前医疗服务工作的通知》明确,医疗机构要继续做好门诊预检分诊工作,通过多种方式查看就诊患者48小时核酸检测结果。门诊区域要划分出核酸阳性和阴性诊疗区,分别接诊相应患者。对于急诊就诊患者不得以没有48小时核酸结果为由影响救治;对出现发热、呼吸道症状等患者,引导至发热门诊就诊,进行抗原或者核酸检测并开展相应诊疗服务。《通知》强调,未经卫生健康部门同意,不得擅自关闭发热门诊。
2.浙江加强“西学中”培训管理。浙江省出台《浙江省非中医类别医师学习中医培训管理办法(试行)》,建立“理论培训学分制、临床实践基地化、管理考核统一化”的西学中人员培养机制,第一阶段为线上理论培训,第二阶段为线下集中培训和临床实践培训,各阶段的培训时间一般为1年。《管理办法》明确,执业医师在取得“西学中”培训合格证后,均可开展与专业相关的中医诊疗活动。
3.甘肃将“两慢病”纳入门诊慢特病保障。甘肃省医保局印发通知,自2023年1月1日起,将高血压、糖尿病“两慢病”纳入门诊慢特病补助范围,进一步减轻省直医保参保患者医疗费用负担。参保人员自认定之日起享受待遇,限额在一年内有效,高血压年度内最高支付限额为1500元,糖尿病年度内最高支付限额为2000元,报销比例按90%计算;每年7月1日之后认定的年度限额减半,不与高血压(并发症)、糖尿病(并发症)重复享受待遇。
评审动态
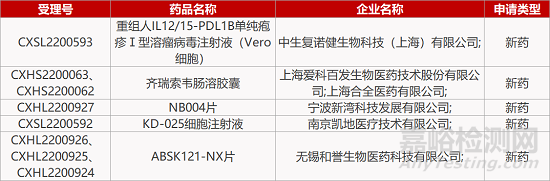
1. CDE新药受理情况(12月08日)
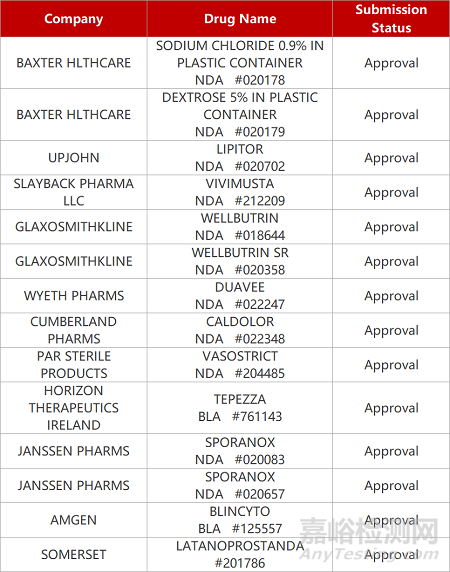
2. FDA新药获批情况(北美12月07日)