您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-15 14:14
作者|张保梅 田 洁 (CDE)
[摘要] 结合美国FDA 2021年9月发布的指南草案“Microbiological Quality Considerations in Non-sterile Drug Manufacturing”(非无菌药品生产中的微生物质量考量)对非无菌药品微生物质量属性的要求,重点对影 响非无菌药品微生物质量属性的风险点进行讨论,以协助生产商更好地控制非无菌药品的微生物质量,减少因微生物污染而引起的药品召回及不良反应事件。此外,对基于风险评估的微生物检查计划进行了讨论,并 提供了相关建议。最后,探讨了水性制剂中的洋葱伯克霍尔德菌(Bcc菌)污染及控制策略。
《非无菌药品生产中的微生物质量考量》 指南 草案(以下简称指南草案) 的起草背景源于美国FDA 对与受污染产品相关的大量不良事件和召回 的担忧,美国 FDA报告称,在 2014-20·7 年收到了197起非无菌药品(Non-sterile Drugs,以下简称 NSDs) 微生物污染或真菌污染引起的不良事件报告,其中32起被视为严重事件。所以美国 FDA 起草该指南 以统一思路,更好地规范和控制 NSDs 的微生物质 量。笔者结合该指南草案及美国药典的相关要求, 从 NSDs 微生物风险评估、基于风险评估的微生物 检测计划、洋葱伯克霍尔德菌(Bcc 菌)污染及控制 策略 3 个方面展开论述,希望协助生产商更好控制NSDs 的微生物质量,更好保证产品质量和患者安 全。同时本文提供了 NSDs 微生物质量控制的一个 新理念,即 NSDs 的微生物控制由终端微生物限度 检测逐渐向微生物风险评估下的参数放行转变的发 展趋势,其理念更为科学合理,控制方法更为简便灵 活,更好地体现了质量源于设计的理念。
01、NSDs 微生物风险评估
在 NSDs 生产过程和产品货架期内控制 NSDs的微生物水平和种类,对保证产品质量和患者安全 至关重要。质量源于设计,良好的设计及适当的过 程控制会降低有害微生物引入或繁殖的风险,影响 NSDs 微生物质量属性的因素主要来自两方面,即与产品本身相关的因素以及与生产相关的因素。下面 对这两方面的因素进行详细的评估分析。
1.1 与产品相关的因素
1.1.1水分活度(Water activity,aw ) aw 直接影响NSDs 的微生物质量,aw 值介于 0 (绝对干燥) ~ 1 (100% 湿度),现行版《中华人民共和国药典》(以下 简称《中国药典》)没有 aw 的相关描述和要求。传统上,低水分活度用于控制食品的微生物变质,比如 干果、糖浆、腌肉和蔬菜等,较低的水分活度使这些 材料能够自我保存[1] 。美国药典(USP) 〈1112〉 引 入了 aw 的相关概念和要求,USP率先将水分活度应 用于制药领域微生物控制,代表了 NSDs 的微生物 控制由微生物限度测试逐渐向微生物风险评估下的 参数放行转变的发展趋势,其理念更为科学合理,控 制方法更为简便灵活[2] 。aw 指在相同温度下,药品 中水的蒸气压和纯水的蒸气压比值[2] 。aw 与水分 含量没有一一对应的关系,aw 用来衡量药品中可以 被微生物利用的水分[3] ,而水分含量是用来衡量药 品中水的体积或重量,即使水分含量低的药品其水 分活度也有可能比较高。一些水可能与药品紧密结 合(例如,作为水合物),不能参与化学、生物化学或 物理化学反应,而一些水可以更自由地参与水解等 反应,或可提供支持微生物生长的环境。确定可用 水(活性水)占总水量的比例很重要,aw的测定提供 了这一信息[2] 。
较低的 aw 将大大有助于防止药品中的微生物 增殖,特定微生物生长有最低 aw 要求,低于此要求 的特定微生物将不能生长。革兰阴性菌中包括某些 致病微生物,如铜绿假单胞菌、大肠埃希菌和沙门菌在 aw < 0.91的产品中不会增殖或存活,而革兰阳性菌如金黄色葡萄球菌将在 aw < 0.86时不会增殖,黑曲霉在 aw< 0.77 时不会增殖。此外,包括最耐受高 渗的酵母菌和耐旱真菌在内的所有微生物在 aw < 0.60 时不会增殖[4] 。也就是说当药品 aw< 0.6时, 一般不会促进微生物的繁殖。高 aw 的 NSDs的微生物控制策略会比较严格,需按照既定的规程进行 微生物检测。
非水性 NSDs 的 aw 应足够低以抑制微生物生 长,当 NSDs 有较高的 aw 时,可能需要额外的生产 过程控制(如加热、严格处方中原辅料的微生物负 荷或进行过滤操作等) 来抵消高 aw对产品微生物 质量属性的影响。
1.1.2 剂型 不同剂型产品的促微生物繁殖能力不同,一般来说,液体剂型的产品促微生物繁殖的潜 在风险高于其他剂型产品,半固体剂型高于固体剂 型。故应对液体剂型的 NSDs 制定更严格的微生物 控制策略。
1.1.3 处方组成 处方中如存在表面活性剂或添 加防腐剂,均能更好地保证产品的微生物质量属性。某些微生物污染风险较高的产品需要选择合适的防腐剂来防止产品在货架期内或者在多次使用过程中 可能发生的微生物侵入或繁殖,已有文献资料显示 某些微生物会降解防腐剂[5] ,所以要确保在药品货 架期内防腐剂的有效性。此外,不能简单地认为处 方中使用了防腐剂就可以代替良好的生产操作规 范,也不能因为使用了防腐剂就降低对处方中原辅 料及中间体微生物负荷的要求,防腐剂只是综合控制措施中的一种。
需要特别关注的是混悬剂,混悬剂产品有可能在贮藏或运输阶段,导致相分离,进而引起防腐剂在 两相之间不均匀分布,防腐剂分布较少的相如果具有较高的aw,会进一步导致微生物生长繁殖。所以,提醒生产商在混悬剂的稳定性考察中应考虑到可能会出现的相分离问题。
1.1.4 产品的预期用途 产品的预期用途需要考虑患者人群、给药途径及使用环境等,如果患者是免 疫力低下的人群,他们更易受微生物感染,容易因微 生物感染而导致不良反应事件;同时还需要考虑给 药途径(如皮肤给药、眼部给药等)及给药部位(给 药部位是否患病或受伤),如果给药途径风险较高 或者给药部位为受伤/ 病患处,那么患者就更容易受 到微生物感染;此外还需要考虑产品的使用环境,如 果产品是在手术室或重症监护室使用,那么它对微 生物质量的要求就比较高,而产品如果是在家或办 公司就能服用的话,对产品的微生物质量要求就相 对没那么严格[6] 。
综上,在制定微生物控制策略及微生物质量标 准时,应考虑到产品的患者人群、给药途径及使用环 境等,对风险高的患者人群、给药途径或使用环境应 制定严格的微生物控制策略及微生物质量标准,更好保证药品质量和患者安全。
1.1.5 产品的包装形式 首先生产商应确保容器/ 包装系统能够提供足够的保护,以防止外来污染源导致产品微生物污染(如水或外来微生物侵入等);在选择 NSDs 包装形式时要考虑是选择单剂量包装 还是选择多剂量包装,对于某些剂型,如 aw 较高的产品,可以选择单剂量包装,打开后一次使用,用完 即弃,在防止外来微生物侵入方面能够提供更好的 安全性。
1.2 与生产相关的因素
1.2.1 生产工艺 某些生产工艺步骤在增加微生 物负荷方面影响较显著,如中间产品暂存的操作步骤,尤其是那些基于水的操作工序,延长其操作时限可能会创造微生物繁殖的条件,导致微生物负荷超 出可接受标准。所以,不建议延长水性中间过程物 料的暂存时限(如水性包衣浆或水性液体混合物)。为保证产品质量需建立某些中间过程步骤的操作时限,并对操作时限进行验证。
某些生产工艺步骤在减少微生物负荷方面的影 响较显著,比如过滤、高温或使用有机溶剂等,这些操作均有利于微生物负荷降低。
下面用 2 个案例详细讨论一下。
案例 1:某口服肠溶片:产品包衣工艺中包衣液 的暂存时限问题,生产企业对包衣液的微生物生长 情况进行了考察并提供了测试报告,结果显示:包衣 液在放置24h内各种测试菌(大肠埃希菌、金葡、枯草芽孢杆菌、白色念珠菌、黑曲霉菌)的数量变化不 明显,但48,72h后白色念珠菌的数量有显著增加, 已超出拟定的可接受标准。所以,该包衣液应在配制后 24h内使用。该包衣预混剂采用纯化水进行配制,由于纯化水非常有利于微生物生长繁殖,故其配制后的暂存时限应进行验证且不能随意延长。
案例 2:某口服肠溶干混悬剂,生产商对其中间 体暂存时限进行研究,其中包括隔离层包衣液(纯 化水配制而成) 的暂存时限考察,考察项目包括需 氧菌总数及霉菌和酵母菌总数,研究结果显示需氧 菌总数结果仅在前15h内符合要求。生产商根据研究结果将隔离层包衣分散液的暂存时限拟定为不超过 15h。
虽然口服固体制剂的aw一般较低,但是固体 NSDs 在生产过程中也存在微生物污染繁殖的风险, 生产商应意识到固体 NSDs 的某些生产步骤,尤其 是那些基于水的生产步骤可能会创造微生物繁殖的 条件,所以建立某些操作工序的操作时限( holding time)对保证产品的微生物质量是十分必要的。
1.2.2 水和水系统 水是药物生产中用量大、使用 广的一种原辅材料,用于生产过程和药物制剂的制备[7] 。制药用水分为饮用水、纯化水、注射用水及 灭菌注射用水,一般应根据各生产工序或使用目的与要求选用适宜的制药用水,这点与欧盟发布的 《制药用水质量指南》的要求基本一致。纯化水可 作为配制普通药物制剂用的溶剂或试验用水,同时也是口服、外用制剂配制用溶剂或稀释剂[7] ,可见, NSDs 的制备一般使用纯化水,所以纯化水是保证 NSDs 微生物质量的关键因素之一。
纯化水是微生物污染的重要来源之一,纯化水有多种制备方法,应严格监测各生产环节,防止微生 物污染。为了保证 NSDs 的微生物质量,必须对水 及水系统进行严格控制。不管水在处方中是作为一 种成分存在,还是作为加工助剂(成品中除去),都 需要对水建立合适的检测方法和限度标准[8] 。用 于口服固体制剂制备的纯化水,美国药典建议的微 生物限度标准是不超过 100CFU·mL-1 ,而对于其他 剂型的产品可能对微生物限度标准的要求更加严 格[9] 。生产中要设计强悍的工艺用水系统,生产商 必须对水系统进行稳健的设计,包括旨在防止有害 微生物的控制措施以及用于监测、清洁和维护的程 序,确保水及水系统质量符合要求。
综上, NSDs 微生物质量属性的实现需要对水及 水系统做出较严格的要求。
1.2.3 设备和人员 不充分的设备清洁工艺,比如设备清洗后未充分干燥,可能会导致微生物污染繁殖,应尽量避免。人是生产过程中最大的污染源,必 须确保人员遵循良好的卫生习惯。生产商应采取措施建立和保持适当的做法,以尽量减少人员将有害微生物引入生产工艺的潜在风险。
上述风险因素并不是一个完整清单,但生产商 在风险管理计划中应予以考虑,以更好保证产品质量。通过以上评估,生产商能够意识到到底是哪些 环节可能会导致产品的微生物负荷量超标,或哪些 环节会引入有害微生物。经过详细的风险评估之 后,生产商对产品工艺和产品本身会有更深的认识, 其控制措施就更有目的性或者说其控制措施更加有 效,最终能够更好保证产品质量和患者安全。
02、基于风险评估的微生物检测计划
质量是设计出来的而不是检验出来的,该理念 在微生物限度检测方面同样适用。微生物限度检测 可以基于风险评估制定相应的检测计划,在风险较 低的情况下对每批 NSDs 进行微生物限度检测可能 是没有必要的,生产商可以基于风险评估建立合理 的微生物检测计划。
测定产品的 aw可以作为一种工具,用于降低微生物限度检测的频率。但仍需考虑其他因素,如处 方中是否有防腐剂、原辅料是否具有良好的微生物质量、工艺中是否有降低微生物负荷的操作、包装系统是否能够提供足够的保护、生产环境及设备的卫 生状况是否符合要求及制药用水系统是否合格等, 以上均是降低微生物限度检测频率时需要综合考虑 的因素[3] 。
固体 NSDs 由于aw比较低,一般不会支持微生物生长。下面分享一个口服固体制剂的案例,并讨论如何通过风险评估来对产品执行周期性检测或者跳检。
某口服肠溶片,生产商申请将当前对终产品进行微生物限度检验的频率由批批检降低为每年检 1 批。这种变更很显然是重大变更的范畴,需要提交补充申请。针对这项变更,生产商首先需要分析影响该口服肠溶片微生物质量的潜在风险点,针对潜 在风险点建立相应的控制策略,并提供相关研究资料。需要提供的支持性研究资料至少应包括以下几点:① 证明该制剂本身具有较低的微生物负荷。② 产品的aw 比较低,可确保不可能发生微生物增殖。③ 近几年生产的多批样品的检测数据,其微生 物限度均符合标准要求。④ 同时应承诺作为GMP结构的一部分,将继续通过在生产设施内设定适当 的综合微生物监测程序,来保证该肠溶片的微生物 学质量等。当生产商提供了充分的研究资料后,我 们可以根据ICHQ6A的相关规定,认为该口服肠溶 片的微生物限度跳批检验可行。
NSDs 中的微生物限度控制符合患者安全的水 平即可,使用过度的控制会增加复杂性或成本,而没 有得到相应的安全获益,对患者或生产商都没有增 加价值的优势[10] 。因此,基于风险评估建立 NSDs的微生物检测计划是一种科学的、切实可行的风险 管理策略。
03、洋葱伯克霍尔德菌(Bcc菌)污染及控制策略
Bcc 菌与现有的微生物限度检查并不冲突,Bcc菌是微生物限度检查的补充,它是一种有害微生物, 属于控制菌的一种。在美国,Bcc 菌是 NSDs 召回 的首要原因[14] 。由于其危害性较大,美国药典及 FDA 近期出台的相关指南均重点关注了 Bcc菌, 在现有微生物限度检查(一般包括需氧菌总数、霉 菌酵母菌总数及控制菌检查) 的基础上对Bcc 菌 提出了新的要求,其具体检测方法详见 USP〈60〉 。现有的关于微生物限度检测所遵循的技术要求汇 总见表 1。
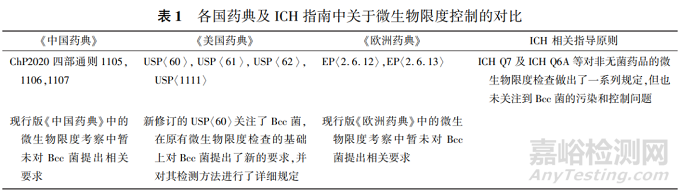
由于 Bcc 菌的危害性较大,我国于近期也开始 关注水性 NSDs 中的 Bcc 菌污染问题。国家药典委 员会已将 Bcc 菌控制纳入《中国药典》2020 年版增 补本(目前该标准草案处于审议阶段,可持续关注 中国药典 2020 年版增补本的动态),2021 年 11月 26 日发布的《化学药品创新药上市申请前会议药学 共性问题及相关技术要求》通告中规定:对于吸入、 口服、黏膜、皮肤和鼻腔给药的水溶液非无菌制剂, 一般应参照相关技术要求对洋葱伯克霍尔德菌进行 研究,制定相应的控制策略。
Bcc 菌是一组革兰阴性菌,包括20多种有效菌 种[11 - 12] 。该菌属于有害微生物之一,对免疫力低下 的人群伤害较大,可能会引起感染甚至死亡。制药 用水和生产过程中使用的天然成分是药品中 Bcc 菌 的主要来源,即 Bcc 菌在固体制剂中出现的风险较小,其主要出现在水性 NSDs 中。由于 Bcc 菌污染 而导致的不良反应事件及药品召回越来越多[13] ,所 以建议生产商在生产水性 NSDs 时应严格遵循GMP,以更好保证产品的微生物质量:① 为工艺操 作的设计和控制建立风险管理计划,以防止 Bcc 菌 污染。② 使用强悍的工艺用水系统(生产商必须对 水系统进行稳健的设计,包括旨在防止有害微生物的控制措施以及用于监测、清洁和维护的程序)。③ 确保各组分均符合微生物负荷量的适当标准。④ 对设备进行恰当的消毒和清洁。⑤ 采用经验证 的抽样程序,以定期对 Bcc 菌的存在进行中控检测 和成品测试。
Bcc 菌的危害性较大,为保证产品质量及患者 安全,生产商在水性 NSDs 生产中需重点关注该菌 的污染问题。我国监管部门也在近期出台了相关技 术要求,在现有微生物限度检查的基础上,对水性NSDs 中的 Bcc 菌提出新的要求,建议对水性 NSDs 开展 Bcc 菌检查和风险评估,以更好控制水性 NSDs 的微生物质量。
04、小结
一项对美国 FDA 执法报告(2012—2019 年)的 分析显示,微生物污染是目前美国 FDA 药品召回的 主要原因之一[14] 。由于 NSDs 微生物污染而导致的 不良事件及药品召回越来越多,故引起了国内外监 管机构的关注,美国FDA 及中国的药品监管机构都 在陆续出台相关的技术指导原则,来规范和控制 NSDs 的微生物污染问题,以更好保证产品质量和患 者安全。
针对 NSDs 微生物质量控制主要有以下 2 点建 议:① 将影响 NSDs 微生物质量的产品因素及生产 因素等应用于 NSDs 的微生物质量控制,通过详细 的风险评估,制定合理的微生物控制策略。将 NSDs的微生物控制由终端微生物限度检查逐渐转变为微 生物风险评估下的参数放行控制,更符合质量源于 设计 ( QbD) 的理念,控制方法也更加简便灵活。② Bcc 菌的危害较大,故建议生产商重点关注水性 制剂中的 Bcc 菌污染问题。在现有微生物限度检查 的基础上,对水性 NSDs 中的 Bcc 菌提出新的要求, 以更好保证药品的微生物质量及患者安全。由于 Bcc 菌的检测方法比较复杂,美国药典已在通则 USP〈60〉中详细描述了 Bcc 菌的检测方法,建议《中 国药典》也尽快将 Bcc 菌的检测列入增修订计划。
本文以美国 FDA发布的指南“ Microbiological Quality Considerations in Non-sterile Drug Manufactur-ing"、《美国药典》的相关规定以及查阅到的相关文 献为基础,详细探讨了 NSDs 中微生物质量控制问 题,并提供了相关建议。如与中国发布的相关技术 要求不一致,请以我国官方发布的技术要求为准。


来源:Internet


