您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-27 06:23
近年来,随着组合化学、高通量筛选技术在药物研发中的广泛应用,涌现了很多分子量较大、结构复杂的化合物,往往具有分子质量大,疏水性强等特点。根据统计,这些化合物中约40%为水难溶性(<10mg/mL)。
由于这些药物极低的水中溶解度,使得其在胃肠道中溶出差,口服生物利用度低,不仅限制了药物制剂开发和临床试验,还阻碍了具有药物活性新化合物的筛选。因此,如何改善难溶性药物的溶解度,提高其生物利用度成为药剂学领域最关键的难题之一。
如何提高溶出度?
目前,已有多种策略来提高难溶性药物溶出及生物利用度。如使用表面活性剂对药物增溶、制备环糊精包合物、固体分散体、脂质体、胶束、固体脂质纳米粒等。然而,这些解决方案存在着载药量低、物理稳定性差、工业化生产困难等问题。
纳米晶体技术,即制备纳米药物晶体,是一种新颖的增加难溶性药物溶解度的药剂学途径。根据Noyes-Whitney和FriendlyOstwald方程,通过降低药物粒径至纳米级,可显著增加药物饱和溶解度和溶出速率。
药物纳米晶体
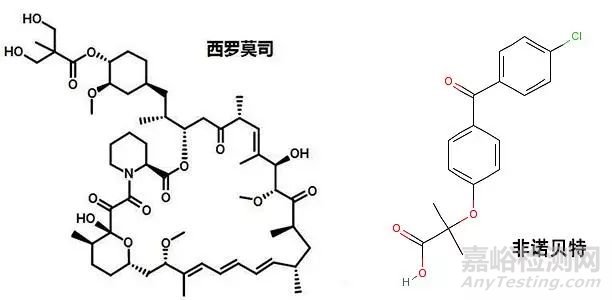
药物纳米晶体的粒径处于纳米尺寸范围,通常为10~1000nm。极小的粒径使得药物具有巨大的比表面积,可解决多数难溶性药物的溶解度和溶出度问题,提高其口服生物利用度,改善体内分布等,目前上市的药物有西罗莫司片剂、非诺贝特片剂、紫杉醇白蛋白纳米混悬剂等。
一、作用机制
纳米晶提高难溶性药物溶出及生物利用度主要是基于其纳米尺寸效应,主要包括提高药物的溶解度,提高药物的溶出速度,生物黏附效应以增加胃肠滞留时间及多种吸收机制并存。
1 提高难溶性药物的溶解度
根据Ostwald-Freundlich方程可知,当药物粒径小于1μm时,药物的溶解度会随粒径的减小而增大,如一种抗菌药其粒径从2.4μm减小至300nm,其溶解度提高了50%。
2 提高难溶性药物的溶出速度
根据Noyes-Whitney方程可知,药物的溶出速度与药物的表面积有关。将药物制备成纳米晶后,其表面积大大增加,如在相同的溶出条件下,西洛他唑的粒径由13μm减小至220nm,药物的溶出速度增加至原来的5100倍。
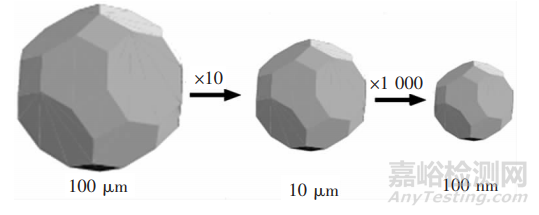
表面积随着粒径减小而增大
3 生物黏附效应
在胃肠道表面存在黏液层,其为多孔结构,类似凝胶。纳米晶由于其粒径小,能够迅速渗透进入黏液层的凝胶孔道中,并紧密黏附于凝胶的网状结构中,因此可延长药物在胃肠道的滞留时间,促进药物的跨膜吸收。
4 多种吸收机制并存
与微米级药物颗粒相比,药物纳米晶可通过多种方式吸收。如药物从纳米晶溶出后,可以分子状态通过被动转运的方式直接跨膜吸收;同时也可以纳米晶的形式通过肠道表面的派氏结经淋巴系统转运吸收;此外还可通过细胞间途径或跨细胞转运进行吸收。
二、纳米药物晶体制备方法
目前,纳米药物晶体制备方法主要可以归纳为2类:”Bottom-up”(从小到大)技术和”Top-down”(从大到小)技术。前者是控制药物分子的结晶过程,以得到粒径处于纳米级别的药物晶体;后者是将大的药物晶体颗粒破碎,以得到药物的纳米晶。
1 ”Bottom-up”法(主要包括沉淀法、乳化法)
①沉淀法:先将难溶药物溶于溶剂(有机溶剂)当中,然后将此溶液加入可混溶的药物反溶剂(水溶剂)当中,搅拌,导致药物浓度过饱和,随之药物沉淀得到纳米药物晶体。
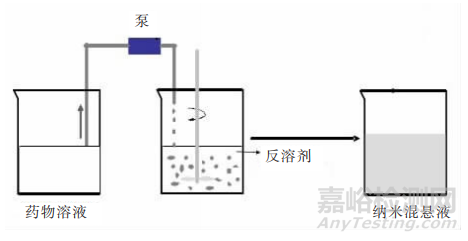
沉淀法示意图
②乳化法:将药物作为分散相溶于易挥发的有机溶剂或与水部分混溶的溶剂中制备成乳剂,然后对乳剂进行蒸发、搅拌、萃取等处理得到纳米药物晶体。
2 ”Top-down”法(主要包括介质研磨法和高压均质法)
①介质研磨法:利用湿法研磨技术,使药物颗粒、研磨介质和器壁之间产生强烈的相互碰撞和剪切力,以致固体颗粒粒径逐渐减小至纳米级别,最终得到纳米药物晶体。
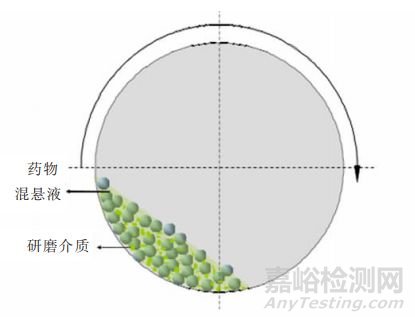
介质研磨法示意图
②高压均质法:主要包括微射流技术和活塞-裂隙均质技术。前者是通过喷射气流的方式,将药物混悬液加速通过特制的均质室,在管腔内经多次改变方向,导致微粒碰撞和剪切,从而减小粒径;后者是先将微粉化的原料药于含有稳定剂的溶剂中高速搅拌分散,制成药物粗混悬液,然后将药物粗混悬液低压均质循环适当次数,进行均质预处理,最后将预处理好的药物混悬液通过狭缝进行10~25次高压均质循环,直到符合粒度要求。
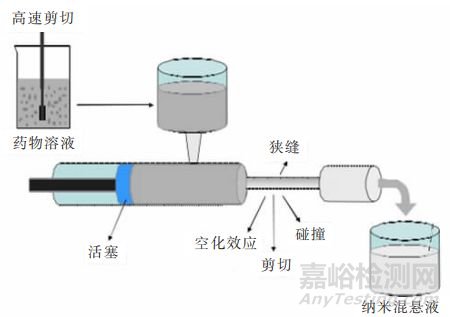
活塞-裂隙均质技术示意图
表1 部分已上市纳米药物晶体
|
药物名称 |
制备方法 |
上市剂型 |
公司 |
|
西罗莫司 |
介质研磨 |
口服片剂 |
惠氏公司 |
|
阿瑞吡坦 |
介质研磨 |
口服胶囊 |
默克公司 |
|
非诺贝特 |
介质研磨 |
口服片剂 |
雅培公司 |
|
非诺贝特 |
高压均质 |
口服片剂 |
Sciele Pharma Inc |
|
甲地孕酮 |
介质研磨 |
口服混悬液 |
Par Pharmaceuticals |
三、所需的稳定剂
在制备过程中,随着药物粒径的减小,粒子的表面自由能显著增大,粒子间产生相互聚集以降低表面自由能的趋势,同时纳米粒子强烈的布朗运动加剧了粒子间不断地相互碰撞,很容易发生聚集、结块、晶体生长或晶态改变等现象。
因此,可在制备过程中加入1种或2~3种稳定剂混合使用,以解决粒子聚集或结块等问题。稳定剂主要分为离子型稳定剂(如阴离子型表面活性剂)和非离子型稳定剂(如非离子型表面活性剂、高分子聚合物)。离子型稳定剂主要通过静电排斥作用保持纳米体系稳定;非离子型稳定剂则主要通过提供空间阻碍作用保持纳米体系稳定。
表2 已上市纳米药物晶体产品中的稳定剂
|
稳定剂 |
药物名称 |
制备方法 |
|
PVP-P188 |
西罗莫司 |
介质研磨 |
|
HPMC-SDS |
阿瑞吡坦 |
介质研磨 |
|
HPMC-SDS-PVPP |
非诺贝特 |
介质研磨 |
|
HPMC-多库酯钠 |
甲地孕酮 |
介质研磨 |
|
帕潘立酮棕榈酸酯 |
吐温20-PEG4000 |
介质研磨 |
|
非诺贝特 |
CMC-卵磷脂-SDS |
高压均质 |
资料来源:
1.纳米药物晶体的制备技术及其应用王廉卿,戎欣玉,刘魁,胡易,高倩,赵树春,李校根,张于驰.
2.纳米晶提高难溶性药物溶出及生物利用度的研究进展王健,段京莉,李邱雪.

来源:粉体圈


