您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-13 11:39
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.瓴路CD19-ADC上III期临床。瓴路药业和ADC Therapeutics SA创建的合资企业瓴路爱迪思宣布,CD19-ADC药物Loncastuximab tesirine的确证性国际Ⅲ期临床LOTIS-5已在中国完成首例患者给药。该项试验拟评估Loncastuximab tesirine与利妥昔单抗联合治疗较标准免疫化学疗法用于弥漫性大B细胞淋巴瘤(DLBCL)二线及以后且不符合移植条件的患者的疗效。Loncastuximab tesirine是首个CD19靶向ADC药物,已获FDA加速批准单药用于复发/难治性DLBCL患者的三线及以上治疗。
2.祐和CD40单抗启动II期临床。百奥赛图旗下祐和医药自主研发的CD40单抗YH003日前在国内启动一项II期临床(编号为YH003006),联合帕博利珠单抗(PD-1单抗)和白蛋白紫杉醇一线治疗不可切除/转移性黏膜型黑色素瘤。在之前的I期临床试验中,YH003显示出良好的耐受性和安全性,并对恶性黑色素瘤,胰腺癌等肿瘤具有的抗肿瘤活性。
3.和誉CSF-1R抑制剂拟纳入突破性品种。和誉医药1类新药ABSK021获CDE拟被纳入突破性治疗品种,针对的适应症为不可手术的腱鞘巨细胞瘤。ABSK021是一款CSF-1R抑制剂,已在临床前研究中显示出对CSF-1R具有良好的效力、选择性,以及抗肿瘤功效。该新药目前正在中美两国开展Ⅰb期临床,以评估用于腱鞘巨細胞瘤、三阴性乳腺癌、肺癌和胰腺癌四种肿瘤中的安全性及有效性。
4.亚盛奥雷巴替尼片拟纳入优先审评。亚盛医药第三代BCR-ABL抑制剂奥雷巴替尼片获CDE拟纳入优先审评,拟用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药和/或不耐受的慢性髓细胞白血病(CML)慢性期(CP)患者。公布于ASH2021年会上的Ⅰ期研究数据显示,奥雷巴替尼在CML-CP患者中达到100%的完全血液学缓解率,70%的完全细胞遗传学缓解率,主要分子学缓解率为55%。此前,奥雷巴替尼用于这一适应症已被CDE纳入突破性治疗品种。
5.药明康德2022年上半年业绩预告出炉。7月11日,药明康德发布2022年上半年业绩预告,预计2022年半年度实现营业收入约人民币177.56258亿元,同比增长约68.52%。第二季度实现营业收入同比增长约66.16%,超出公司此前公告的63%到65%的二季度预计收入增长率。预计2022年半年度实现归属于本公司股东的净利润同比增长约73.29%、基本每股收益同比增长约72.83%,均超过同期收入增速。
国际药讯
1.减肥药Qsymia获FDA批准用于儿童。FDA批准Vivus公司芬特明和托吡酯缓释胶囊Qsymia用作低热量饮食和增加体力活动的辅助手段,用于BMI≥95%、≥12岁的肥胖儿童患者的慢性体重管理。一项对照研究56周数据显示,Qsymia作为辅助手段使12-17岁肥胖青少年受试者BMI分别降低了4.8%和7.1%,而安慰剂组这一数值平均增加了3.3%。Qsymia已在2012年7月获得FDA首次批准,用于肥胖或超重并至少有体重相关合并症(如高血压、2型糖尿病或血脂异常)的成人慢性体重辅助管理手段。
2.处方避孕药向FDA提交OTC申请。HRA Pharma公司日服处方避孕药Opill(黄体酮)在美国递交了非处方药申请。据悉,该产品已于1973年获FDA批准上市,已被数百万女性证实安全有效。HRA公司预计FDA将在10个月内做出决定。如果获批,这将是美国首款非处方避孕药,将帮助更多的女性和人们获得避孕措施。
3.罗氏血友病新药Ⅲ期临床数据积极。罗氏旗下基因泰克靶向凝血因子IXa与凝血因子X的双抗药物Hemlibra(emicizumab),在ISTH2022年会上公布用于轻中度血友病A的Ⅲ期临床(HAVEN 6)最新结果。在中位随访为55.6周时,有66.7%的患者没有出现需要治疗的出血情形,有81.9%患者没有产生需要治疗的自发出血状况,有88.9%患者没有出现需要治疗的关节出血。该药年出血率维持0.9的低值(95% CI:0.55-1.52),安全性与以往试验一致。
4.赛诺菲长效血友病A疗法最新结果公布。赛诺菲与Swedish Orphan Biovitrum AB联合开发的新型凝血因子VIII重组蛋白Efanesoctocog alfa(BIVV001)在ISTH2022年会上公布用于治疗严重性血友病A患者的Ⅲ期临床(XTEND-1)积极结果。数据显示,接受一周一次efanesoctocog alfa治疗的患者中位与平均年出血率(ABR)分别为0.00(四分位距:0.00-1.04)与0.71(标准差:1.43)。治疗组与对照组的平均ABR分别为0.69与2.96,预估BIVV001降低了约77%的年出血率。
5.肺纤维化新药Ⅱa期临床成功。Pliant公司口服小分子αvß6/αvß1双抑制剂PLN-74809治疗特发性肺纤维化(IPF)的Ⅱa期临床INTEGRIS-IPF达到主要与次要终点。与安慰剂相比,PLN-74809治疗组第12周时患者的用力肺活量(FVC)减少幅度更少(-15.1 mL vs -74.1 mL)减少幅度降低80%。临床中未观察到药物相关的严重不良反应(SAE),大部分的治疗伴发不良反应(TEAE)多属轻中度。该药此前已获FDA授予快速通道资格与孤儿药资格。
6.Vertex拓展糖尿病产品管线。Vertex公司宣布将斥资3.2亿美元收购ViaCyte公司。ViaCyte致力于开发用于1型糖尿病的创新干细胞生成的细胞替代疗法。ViaCyte现有的在研产品包括胰岛细胞替代疗法PEC Direct(VC-02),以及与CRISPR Therapeutics联合开发的干细胞分化胰岛细胞疗法VCTX210。此次收购将扩展Vertex公司旨在功能性治愈1型糖尿病的干细胞研发管线。此前Vertex公司同种异体干细胞VX-880已获得治疗1型糖尿病的临床概念验证。
医药热点
1.福建将开展“无陪护”病房试点。福建省卫健委、省财政厅等部门日前联合印发通知,提出按照财政、医保、患者各负担一点的原则,在全省范围内开展“无陪护”病房试点工作。所谓“无陪护”,并非无人陪护,而是由经过规范化培训的医疗护理员替代家属承担患者住院期间的生活照护,推动病区医疗、护理和生活照护有机结合,实现无家属陪护或陪而不护。护理员将由试点医院统一聘用。据悉,该省今年计划培训2500名医疗护理员。
2.北京将建社区专病特色科室培育基地。北京市卫健委日前印发《关于进一步深化社区卫生服务机构专病特色科室建设工作的通知》,宣布将在三级医疗机构及专科医疗机构建设社区专病特色科室培育基地,并按照“医联体优先、双向选择、统筹安排”的原则,指导帮助社区卫生服务机构开展专病特色科室建设。到今年年底,至少建成50个符合标准的社区专病特色科室;到2025年,全市建成300个社区专病特色科室。
3.城乡居民医保筹资标准继续提高。近日,国家医保局、财政部、国家税务总局印发《关于做好2022年城乡居民基本医疗保障工作的通知》。《通知》明确,今年继续提高城乡居民基本医疗保险筹资标准。各级财政继续加大对居民医保参保缴费补助力度,人均财政补助标准新增30元,达到每人每年不低于610元,同步提高个人缴费标准30元,达到每人每年350元。
评审动态
1. CDE新药受理情况(07月12日)
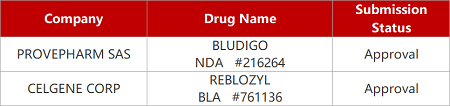
2. FDA新药获批情况(北美07月08日)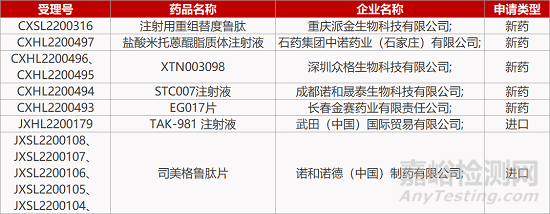

来源:药研发


