您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-27 11:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.传奇BCMA CAR-T获欧盟附条件批准。传奇生物开发的BCMA-CAR-T疗法CARVYKTI(西达基奥仑赛, cilta-cel)获欧盟委员会(EC)附条件批准上市,用于治疗既往接受过至少三种治疗(包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体)并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤成人患者。在关键Ⅰb/Ⅱ期CARTITUDE-1研究中,cilta-cel达到98%的缓解率和83%的完全缓解率。FDA已于今年2月批准该新药上市。
2.恒瑞造影剂仿制药获FDA批准上市。FDA批准恒瑞提交的碘克沙醇注射液简略新药申请。碘克沙醇注射液是挪威奈科明制药原研的X-线对比剂,适用于成人及儿童的动脉数字减影血管造影、心血管造影、外周动脉及静脉造影、内脏动脉造影、脑动脉造影、头部及身体CT成像、排泄性尿路造影、冠状动脉CT血管造影(CCTA)。该品种2021年全球销售额约为8.73亿美元,目前国外尚无同类仿制药获批。
3.武田CD38单抗在华报IND。CDE受理武田CD38靶向IgG1抗体Mezagitamab(TAK-079)注射液的临床试验申请。TAK-079具有CD38高亲和力,可通过抗体和补体依赖性细胞毒性消耗表达CD38的肿瘤细胞。在复发或难治性多发性骨髓瘤患者中,应用Mezagitamab治疗具有免疫调节作用,与降低肿瘤负荷、B和T调节细胞亚群相关,并观察到的免疫环境变化与将肿瘤微环境从冷环境转换为热环境的免疫学概念一致。
4.诺诚健华CD19单抗国内获批II期临床。诺诚健华从Incyte引进的CD19单抗注射用Tafasitamab获国家药监局临床试验默示许可,拟联合来那度胺开展单臂、开放、多中心II期临床,评价联合治疗不适合自体干细胞移植条件的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者的安全性和有效性。在海外,这一组合疗法用于上述适应症已获得FDA和EMA有条件批准上市。
5.齐鲁PD-1/CTLA-4双抗获批肺癌临床。齐鲁制药1类生物药QL1706注射液获国家药监局临床试验默示许可,拟用于治疗广泛期小细胞肺癌。QL1706是齐鲁制药自主研发的一款PD-1/CTLA-4组合抗体,已在中美两国获批同步临床开发。目前,齐鲁制药正在开展QL1706 联合卡铂和依托泊苷一线治疗广泛期小细胞肺癌的Ⅱ期临床;评价QL1706治疗复发或转移性宫颈癌的Ⅱ期临床;以及QL1706治疗晚期肝细胞癌的Ⅰb期临床。
6.华润双鹤引进一款口服新冠候选药。华润双鹤日前发布公告,宣布以不超过2075万美元获得Ligand Pharmaceuticals (美商莱根制药)公司一款临床前期的口服新冠候选药物LGN-20在亚洲区域内(除以色列、俄罗斯、土耳其)独占开发、生产及商业化权益,以及在产品获批后相关专利的转让。LGN-20是一款RdRp抑制剂,与君实生物的VV116属于同一技术路线。
国际药讯
医药热点
1.百济神州宣布新人事任命。百济神州近日宣布,朱晶岩(Emma Zhu)于2022年5月20日正式加入百济神州,担任血液肿瘤事业部负责人,直接向大中华区首席商务官殷敏(Eva Yin)汇报。在加入百济神州之前,朱晶岩曾是杨森HIPO事业部淋巴瘤业务部负责人。此前,朱晶岩还在诺华任职超过10年,历任战略市场经理、心血管DIOVAN负责人等职位。
2.我国首家血管重症监护室成立。5月24日,北京大学首钢医院宣布,医院血管医学中心血管重症监护室(VCU)正式成立并启动运营。这是我国首家血管相关疾病重症监护室,共设置床位4张。在前期的试运行阶段,VCU主要收治肺栓塞、主动脉夹层、足坏疽感染和急性心力衰竭等急危重症患者,以及血管介入手术高风险人群。
评审动态
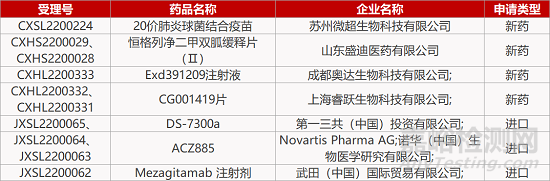
1. CDE新药受理情况(05月26日)

来源:药研发


