您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-26 05:50
摘要:血源筛查试剂,指用于血源筛查的体外诊断试剂,其质量与公共健康密切相关。本文重点关注血筛试剂的种类、监管现状、质量控制、相关标准物质和标准等。
关键词:血筛试剂;质量控制; 监管
Abstract: Blood screening diagnostic kit refers to the in vitro testing assay kit used for blood source screening, and its quality is closely related to public health. The review focuses on blood screening reagents, regulations, quality control, and requirements/standards.
Key words: blood screening diagnostic kit; quality control; regulation
乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)和梅毒螺旋体(Treponema pallidum,TP)等病原体,可经输血传播而造成严重的公共健康危害[1,2]。目前,乙肝疫苗可以有效控制和预防HBV感染;HCV尚无有效的预防性疫苗可供使用[3];梅毒流行形势日益严峻,需要“预防为主,防治结合”[4];HIV仍无有效的根治手段和疫苗,阻断这些病原体经血传播是防控的主要措施,高质量的血源筛查诊断试剂是保障输血及血液制品安全的关键。本文主要介绍血筛试剂的种类、监管现状、质量控制、相关标准物质和标准等。
1 血筛试剂的种类
在我国,血源筛查诊断试剂按照生物制品进行管理,主要分为血清学检测试剂和核酸检测试剂两大类。
1.1 血清学血筛试剂
血清学血筛试剂采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测前述主要经血传播病原体的抗体和/或抗原。根据反应原理,酶联免疫吸附法可分为间接法(indirect ELISA)、夹心法(还有双抗原夹心法)(sandwich ELISA)和竞争法(competitive ELISA)等类型。
主要血清学血筛试剂经历了长期使用和发展,性能稳步提高,例如,HIV血清学血筛试剂经历了四代产品更迭换代。第一代HIV诊断试剂使用病毒裂解HIV抗原包被在固相上,与检测样品中的特异抗体结合,用酶或荧光标记的抗人IgG作为标记抗体,检测HIV IgG抗体[5-7]。由于病毒裂解抗原通常会含有宿主细胞的成分,易造成假阳性。通过降低包被抗原的浓度,可降低假阳性率,但灵敏度会受到一定影响[6]。第二代HIV诊断试剂使用基因工程重组和/或人工合成多肽作为包被抗原,检测原理与第一代试剂相同。由于第二代试剂的包被抗原同时含有HIV1和HIV2的抗原,因此可同时检测 HIV1和HIV2抗体[5,6],与第一代试剂相比,敏感性明显提高,但鉴于间接法在方法学上的局限性,其敏感性和特异性仍存在一定限制[6]。第三代HIV诊断试剂主要使用基因工程重组抗原并采用双抗原夹心法的原理检测HIV的总抗体(包括IgG抗体和IgM抗体),进一步缩短了窗口期并提高试剂的敏感性和特异性[7]。第四代HIV诊断试剂是在第三代试剂的基础上加入HIV1 p24抗原检测系统,可同时检测血清/血浆中HIV抗体和p24抗原,窗口期平均可以提前4~8 d[8],敏感性进一步提高。尤其对于阳性灰区样本,第四代诊断试剂可以检出阳性反应,而第三代试剂检测显示高值阴性[9]。
1.2 核酸血筛试剂
尽管血清学试剂经过不断发展,特异性和敏感性都得到了提高,但仍存在病原体感染后抗体和/或抗原不能检出的“窗口期”,仍存在经输血传播的感染病例[10,11]。此外,研究证实,尽管在血源筛查检测的同时还增加了病毒灭活工艺,但是血液制品的输注仍存在传播HBV、HCV和HIV的残留风险[10, 12-14],因此,对于输血或血液制品的安全来说,单纯检测抗原和/或抗体仍存在一定的风险。核酸检测技术(nucleicacid testing,NAT)是一系列直接检测病原体核酸技术的总称, 主要原理是通过靶核酸直接扩增或对其附带信号扩增的方法, 让极微量的核酸变成直观的光电信号或可视信号, 从而判断标本中是否存在相应的病原体,可以大大缩短检测“窗口期”,降低经输血传播病毒的风险[15]。有研究对经ELISA检测合格的献血者标本采用核酸检测技术检测乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒核酸,结果显示总反应性率为0.09%,进口试剂反应性率为0.10%,国产试剂反应性率为0.08%,其间差异无统计学意义(P>0.05),我国国产核酸血源筛查试剂与进口核酸血源筛查试剂在检出性能上没有显著差异[16]。
截至目前,基于PCR技术的核酸血筛试剂主要经历了五代的发展[17]。第一代核酸血筛试剂,以罗氏诊断研发的Cobas Ampli Screen HBV/HCV/HIV tests为代表,这种试剂在扩增结束后加入酶标记的寡核苷酸探针与DNA扩增子特异性结合,通过酶催化底物显色反应的强度检测靶分子,也称为终点检测[18]。第二代核酸血筛试剂,如国内企业研发的HBV、HCV、HIV1核酸血筛试剂,采用实时荧光PCR技术,并分为混样检测及鉴别检测,即先对样品汇集池进行检测,若为阳性,则对池内每一份样品分别检测,从而鉴别出阳性样本。第三代核酸血筛试剂以罗氏诊断的cobas TaqScreen MPX Test为代表,采用荧光PCR技术实时检测,与第一代相比,自动化程度更高,且可进行混样检测和拆分检测,但阳性结果不能报告检出核酸阳性的病原体种类[17, 19, 20]。第四代核酸血筛试剂的代表是我国上海浩源生物技术有限公司研发的五色荧光多重PCR法核酸血筛试剂, 是全球首个获批的五色荧光多重PCR法核酸血筛试剂[17],可在一个PCR管中同时进行HBV DNA、HCV RNA和HIV1 RNA的实时荧光检测, 并判别检为阳性的病原体种类,大大提高了检测效率。第五代核酸血筛试剂的主要改进在于HIV RNA的检测能力,可同时检HIV1 M组和O组,以及HIV2 RNA、HBV DNA和HCV RNA,扩大了靶分子的覆盖范围,提高了病原体检出率,降低了经血传播的感染可能性[21, 22]。
此外,还有一种核酸血筛试剂,TMA化学发光法核酸血筛试剂,采用基于TMA技术扩增和终点检测的方式,检测模式包括混样检测、拆分检测及鉴别检测。该类产品包括Genprobe公司/Chiron疫苗和诊断产品公司共同研发的HCV Assay、Procleix Ultrio Blood Screening Assay、Procleix Ultrioplus Blood Screening Assay和Procleix Ultrio Elite Blood Screening Assay等四个版本的试剂。研究表明,这类试剂和第三代核酸血筛试剂的检测结果有较高的一致性,但对低浓度样本的检测结果存在一定差异[22]。
核酸检测灵敏度高,特异性好,但检测成本较高,对检验人员、检测过程及环境的要求也高,目前尚未在全国普及。实际血液筛查中,应该视不同地区疾病流行状况、基础设施设备及经济状况,采用不同的检测策略,多数血液中心采用两种不同ELISA试剂进行检测,对于感染率高、有条件的地区可以采用血清学检测与核酸检测结合的方式进行检测[12,21,23,24]。
2 质量控制
影响试剂质量的因素主要包括原材料、生产工艺等。生产血清学血筛试剂所需的原材料主要有包被抗原/抗体、标记抗原/抗体、酶、对照等,生产核酸血筛试剂所需的原材料主要有的引物、探针、工作酶、内标、阴/阳对照等,这些专用原材料的质量、工作浓度及制备工艺等均直接影响试剂的敏感性、特异性等性能。因此,试剂的质量控制需着眼于生产全过程,并在质量控制的关键节点采用标准物质予以检定,符合质量标准才能放行。
2.1 标准物质—参考品
试剂生产过程中,应在关键节点进行检定,如原料检定、半成品检定和成品检定等,以及时把控试剂的质量,保障放行试剂的安全有效。检定时需采用经验证的标准物质评估半成品和成品的主要性能指标,合格后方可进入下一步生产流程或放行。血筛试剂检定用标准物质分为企业参考品和国家参考品,前者一般由生产企业研制,主要用于半成品和成品检定;后者则由中国食品药品检定研究院研制,主要用于成品检定,包括注册检验、批签发和进口检验。随着诊断试剂的不断发展,对其质量要求也不断提高,相应品种的国家参考品也进行了增加和换批/换代[25-27]。目前,用于血筛试剂质量控制和评价的国家参考品主要有HIV抗体国家参考品、HIV1 p24抗原国家参考品[28]、HIV1核酸血筛试剂国家参考品[29]等9个品种(见表1)。
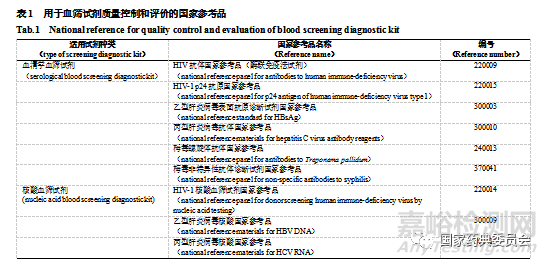
上述国家参考品的组成主要包括阳性参考品、阴性参考品、最低检出限/灵敏度参考品、精密性/重复性参考品,用于综合评价血筛试剂的准确性、特异性、灵敏度及稳定性等性能。敏感性不足,易出现假阴性结果,导致漏检;特异性不足,易出现假阳性结果,导致错检;灵敏度不足则易将低值(临界值)样本检为阴性,导致漏检;重复性不好,反映试剂不稳定,自然也无法保证准确性。有研究利用HIV1 p24抗原国家参考品和HIV抗体国家参考品对不同厂家生产的HIV血液筛查试剂进行评价,结果显示所检国内外试剂均符合国家现行标准,但与进口试剂相比,国产试剂在最低检出量和批间精密性方面尚有提高的空间[30]。由此可见,国家参考品可以为血筛试剂的质量控制与评价提供客观公正的“标尺”,不仅在保障我国用血安全方面发挥十分积极的作用,还可以发现国内外同类试剂的质量差距,为试剂的性能优化提供方向。
2.2 标准及法规
鉴于血筛试剂对阻断病原体经血传播的极端重要性,国内外均制定了相关标准及法规对其生产全过程进行质量控制,如《中华人民共和国药典》(简称《中国药典》)、《药品生产监督管理办法》及《生物制品批签发管理办法》等。随着科技发展,试剂的性能不断提升,《中国药典》在首次将血筛试剂收载之后,对血筛试剂的质量控制要求也进行不断改进。2010年版《中国药典》规定了试剂的检测程序及反应时间,要求加入检测样本后反应时间不得低于60 min,目的是确保抗原抗体能充分反应,进一步提高试剂的整体性能[31]。2020年版《中国药典》收录的血源筛查试剂则有了较大的变化,主要包括:⑴新增了人类免疫病毒抗原抗体诊断试剂盒(酶联免疫法)和核酸血筛试剂(即:乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒)两个品种;⑵将HIV1 p24抗原最低检出量的要求,由 “不得高于5 IU·mL-1”提高为“不得高于2.5 IU·mL-1”,与国外相关要求保持一致;⑶鉴于当前酶联免疫法检测HIV1/HIV2抗体均采用两步法,取消了对前带(hook)效应进行评价的要求[32];⑷参考国内外血源筛查试剂的质量控制要求,将“无菌试验”修改为“微生物限度检查”,更符合体外诊断试剂生产和应用的实际情况。
根据《药品生产监督管理办法》[33]和《生物制品批签发管理办法》[34]等法规和要求,血源筛查试剂应按照国家药品监督管理部门批准的工艺进行生产,并符合国家药品标准和国家药品监督管理部门核准的药品注册标准。生产企业应当按照《药品生产质量管理规范》,建立和健全质量管理体系,确保适当的生产过程控制和质量控制;生产所需原辅料应当建立相应的质量标准;应当建立试剂成品的出厂放行规程,明确放行的标准和条件。
2.3 监管现状
为保障质量,国内外一般都对血筛试剂实行批签发管理。在美国,血筛试剂按照生物制品集中式管理,批签发检验和监管都由美国食品药品监督管理局(Food and Drug Administration,FDA)下属的生物制品评价和研究中心(Center for Biologics Evaluation and Research,CBER)执行[35]。FDA网站公布的血筛试剂主要包括HBV、HCV、HIV等血清学检测试剂,以及HBV、HCV、HIV、西尼罗病毒和寨卡病毒核酸检测试剂等。批签发检验采用FDA提供的参考品或FDA认可的参考品。在欧盟,血筛试剂按照医疗器械管理,因涉及国家较多,规定相对简单且灵活,各国关于批签发有不同的管理要求[35]。
我国《生物制品批签发管理办法》[34]中明确指出,批签发是指国家对获得上市许可的、用于血源筛查的体外诊断试剂在每批产品上市销售前或者进口时,经指定的机构进行审核、检验,对符合要求的发给批签发证明的活动,未通过批签发的产品不得上市销售或者进口。我国1994年开始对血清学检测血筛试剂实施批签发,经过多年批签发管理,试剂质量不断提高,并维持在较好的水平[6,36],对保障我国血清学检测血筛试剂的质量和临床用血安全发挥了重要作用[6,35]。目前,我国已经对7种传染病类血源筛查试剂实行批签发管理(见表2),对于核酸血筛试剂,正在进行相关的准备工作,即将开始实施批签发。

3 结语
确保血筛试剂的质量需要生产企业、检验机构及监管部门等共同努力,实行全过程、全方面的严格质量控制。在顶层设计和实践总结的基础上,我国血筛试剂批签发管理制度不断完善,标准不断改进,为血筛试剂的质量控制起到很好的导向作用。标准物质方面,国家参考品紧跟法规和标准发展趋势,兼顾试剂生产的实际状况,不断更新换代,更加科学合理评价血筛试剂的质量。生产企业也紧跟法规及标准,在保障试剂质量的前提下,不断优化试剂性能。
涉及血筛试剂质量的各部门或机构,都需要以高度的责任感做好血筛试剂的质量控制工作,践行食品药品监管“四个最严”(最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责)的要求。在此基础上,我们要不断总结和分析新标准新办法实施以来存在的问题和经验,为更好地控制血筛试剂的质量奠定良好的基础,继续为血液和血制品的安全做出贡献。
参考文献
[1] 韩选伟, 胡同平, 张文兰. 10681例输血前,术前,产前患者感染性疾病标志物检查结果分析 [J]. 中国医学创新,2012, 9(5):71
HAN XW, HU TP, ZHANG WL. Analysis of markers of infectious diseases in before transfusion,preoperative and prenatal patients[J]. Med Innov China Feb, 2012, 9(5):71
[2] 付俊玲. 输血前8项感染性指标的检测及临床意义 [J]. 中国实用医药, 2015,(18): 144
FU JL. Detection and clinical significance of 8 infectious indexes before blood transfusion [J]. China Prac Med, 2015, (18):144
[3] 魏来,段钟平,王贵强. 丙型肝炎防治指南(2019年版) [J]. 实用肝脏病杂志, 2020, 23(1): s33
WEI L, DUAN ZP,WANG GQ.Guidelines for the prevention and treatment of hepatitis C ( 2019 version)[J]. J Prac Hepatol, 2020, 23(1):s33
[4] 中华人民共和国卫生部. 中国预防与控制梅毒规划(2010—2020年) [EB/OL].[20100603].http://www.gov.cn/ gzdt/201006/21/content_1632301.htm
Ministry of Health, PRC. China′s syphilis prevention and control program (20102020) [EB/OL]. [20100603]. http://www.gov.cn/gzdt/201006/21/ content_1632301.htm
[5] 强来英. HIV抗体诊断试剂的发展 [J]. 中国健康教育, 2006, 22(11): 863
QIANG LY. Development of HIV antibody diagnostic reagents [J]. Chin J Health Edu, 2006, 22 (11): 863
[6] 王佑春, 尹红章. 国产艾滋病病毒检测试剂的发展状况 [J]. 中国药事, 2006, 20(3): 179
WANG YC, YIN HZ. Development status of domestic HIV testing reagents [J]. China Pharm, 2006, 20 (3): 179
[7] 王晓娟. HIV检测试剂的发展及应用 [J]. 中国生物制品学杂志, 2008, 21(004): 346
WANF XJ. Development and application of HIV testing reagents [J]. Chin JBiol 2008, 21 (4): 346
[8] 许文燕, 邱茂锋, 佐合拉·吐尔地, 等. 第四代HIV抗原抗体酶联检测试剂缩短HIV检测窗口期的研究 [J]. 中华检验医学杂志, 2007, 30(3): 284
XU WY, QIU MF, ZOHELA Turdi, et al. Study on shortening the HIV detection window with the fourth generation HIV antigen antibody ELISA reagent [J]. ChinJ Lab Med, 2007, 30 (3):284
[9] 谢进荣, 张兴明, 王淑芳. 第3代和第4代HIV检测试剂对无偿献血人群筛查结果比较 [J]. 中国输血杂志, 2012, 25(12): 2
XIE JR, ZHANG XM, WANG SF. Comparison of screening results of the third and fourth generation HIV testing reagents for unpaid blood donors [J]. Chin J Blood Transf, 2012, 25 (12): 2
[10] 金一鸣, 方志红, 陆荣. 血液筛查中1例低浓度HIV窗口期标本的检测 [J]. 临床输血与检验, 2018, 20(1): 42
JIN YM, FANG ZH, LU R. Detection of a low concentration HIV window sample in blood screening [J]. Clin Blood Transf Test, 2018, 20 (1): 42
[11] 王迅, 高峰, 张钦辉. 上海地区输血后丙型肝炎感染的历史与现状 [J]. 中国输血杂志, 2001,14(6): 395
WANG X, GAO F, ZHANG QH. History and current situation of post transfusion hepatitis C infection in Shanghai [J]. Chin J Blood Transf, 2001,14(6): 395
[12] 赵艳梅, 李艳, 史志旭, 等. 无偿献血者标本血清学和核酸检测情况分析 [J]. 临床血液学杂志, 2019,32(8): 5
ZHAO YM, LI Y, SHI ZX, et al. Analysis of serology and nucleic acid detection of unpaid blood donors [J]. J Clin Hematol, 2019, 32(8): 5
[13] BUSCH M P, KLEINMAN S H, JACKSON B, et al. Committee report. Nucleic acid amplification testing of blood donors for transfusion transmitted infectious diseases: Report of the Interorganizational Task Force on Nucleic Acid Amplification Testing of Blood Donors [J]. Transfusion, 2010, 40(2): 143
[14] OLUYINKA O O, TONG H V, TIEN S B, et al. Occult hepatitis B virus infection in Nigerian blood donors and hepatitis b virus transmission risks [J]. PLoS One, 2015, 10(7): e0131912
[15] 任芙蓉. 核酸检测技术在国内外血液筛检中的应用 [J]. 北京医学, 2008, 30(8): 561
REN FR. Application of nucleic acid detection technology in blood screening at home and abroad [J]. Beijing Med J,2008, 30 (8):561
[16] 梁启忠, 程玉根. 核酸检测技术在献血者血液筛查中的应用 [J]. 国际检验医学杂志, 2015,(22):3265
LIANG QZ, CHENG YG. Application of nucleic acid detection technology in blood screening of blood donors [J].Int J Lab Med, 2015,(22):3265
[17] 许四宏, 王佑春. HBV/HCV/HIV核酸血筛试剂的研究及应用进展 [J]. 临床输血与检验, 2018, 20(6): 581
XU SH, WANG YC. Research and application progress of HBV / HCV / HIV nucleic acid blood screening reagent [J].J Clin Transf Lab Med,2018, 20 (6): 581
[18] KOPPELMAN M, SJERPS M C, REESINK H W, et al. Evaluation of COBAS AmpliPrep nucleic acid extraction in conjunction with COBAS AmpliScreen HBV DNA, HCV RNA and HIV1 RNA amplification and detection [J]. Vox Sanguinis, 2010, 89(4): 193
[19] OHHASHI Y, PAI A, HALAIT H, et al. Analytical and clinical performance evaluation of the cobas TaqScreen MPX Test for use on the cobas s 201 system [J]. J Virologic Methods, 2010, 165(2): 246
[20] LISA J, JANINE B, ALZIRA T, et al. Evaluation of the Roche cobas s 201 system and cobas Taq Screen multiplex test for blood screening: a European multicenter study [J]. Transfusion, 2008, 48(9):1853
[21] 张新龙, 马红丽, 陈悦科, 等. HBV、HCV、HIV核酸检测试剂在洛阳地区血液筛查中的应用与分析 [J]. 社区医学杂志, 2014,12(23): 9
ZHANG XL, MA HL, CHEN YK, et al. Application and analysis of HBV, HCV and HIV nucleic acid detection reagents in blood screening in Luoyang [J].J Community Med, 2014, 12(23): 9
[22] 许四宏, 宋爱京, 聂建辉,等. 两种进口HBV/HCV/HIV核酸筛查试剂的质量评价 [J]. 中国生物制品学杂志,2010, 23(10):1109
XU SH, SONG AJ, NIE JH, et al. Quality evaluation of two imported HBV/HCV/HIV nucleic acid screening reagents [J]. Chin J Biol, 2010, 23 (10): 1109
[23] 张锋, 张琼, 林碧, 等. 血清学联合核酸检测在献血者血液筛查中的互补性 [J]. 中国艾滋病性病, 2016, 22(3): 197
ZHANG F, ZHAGN Q, LIN B, et al. Complementarity of serology combined with nucleic acid detection in blood screening of blood donors [J]. Chin J AIDS STD, 2016, 22(3):197
[24] 刘强, 钱榕, 彭继红, 等. 病毒核酸检测在采供血机构血液筛查中的应用 [J]. 实验与检验医学, 2010, 28(4): 375
LIU Q, QIAN R, PENG JH, et al. Application of virus nucleic acid detection in blood screening in blood collection and supply institutions [J]. Exp Lab Med, 2010, 28 (4):375
[25] 祁自柏, 周诚. 第3代丙肝试剂国家参考品的研制及初步应用 [J]. 中国生物制品学杂志, 1999,12(2):3
QI ZB, ZHOU C. Development and preliminary application of the third generation national reference of hepatitis C reagent [J]. Chin J Biol, 1999, 12(2):3
[26] 谷金莲, 祁自柏, 扬振, 等.第5套丙型肝炎病毒抗体诊断试剂国家参考品的研制 [J]. 中国生物制品学杂志,2006,19(1):68
GU JL, QI ZB, YANG Z, et al. Development of the fifth set of national reference for hepatitis C virus antibody diagnostic reagent [J]. Chin J Biol, 2006, 19(1):68
[27] 谷金莲, 于洋, 梁争论. 第6套丙型肝炎病毒抗体诊断试剂国家参考品的研制 [J]. 中国生物制品学杂志, 2016, 29(7): 720
GU JL, YU Y, LIANG ZL. Development of the sixth set of national reference materials for hepatitis C virus antibody diagnostic reagents [J]. Chin J Biol, 2016, 29 (7): 720
[28] 许四宏, 宋爱京, 李秀华, 等. HIV1 P24抗原国家参考品的研制 [J]. 中国病毒学, 2006, 21(2): 102
XU SH, SONG AJ, LI XH, et al. Development of national reference material for HIV1 P24 antigen [J]. Chin Virol,2006, 21 (2): 102
[29] 许四宏,宋爱京,聂建辉,等. HIV1核酸血筛试剂国家参考品的研制[J]. 中国生物制品学杂志,2009,22(2):174
XU SH, SONG AJ, NIE JH, et al. Development of national reference for HIV1 nucleic acid blood screening reagent [J]. Chin J Biol, 2009, 22 (2): 174
[30] 宋爱京, 许四宏, 李秀华, 等.国产第四代HIV血液筛查试剂的质量评价 [J]. 中国生物制品学杂志, 2013, 26(12): 1797
SONG AJ, XU SH, LI XH, et al. Quality evaluation of domestic fourth generation HIV blood screening reagent [J]. Chin J Biol, 2013, 26 (12): 1797
[31] 中华人民共和国药典2010年版.3部[S]. 2010:338
ChP 2010.Vol Ⅲ[S].2010:338
[32] 中华人民共和国药典2020年版.3部[S]. 2020:417
ChP 2020.Vol Ⅲ[S]. 2020:417
[33] 国家市场监督管理总局. 国家市场监督管理总局第28号令药品生产监督管理办法 [EB/OL]. [20200122].https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/bmgzh/20200330182901110.html
State Administration of market supervision Decree No. 28 of the State Administration of market supervision and administration measures for the supervision and administration of drug production [EB/OL]. [20200122]. https://www.nmpa.gov.cn/ directory/ web/ nmpa/xxgk/fgwj/bmgzh/20200330182901110.html
[34] 国家市场监督管理总局. 国家市场监督管理总局第33号令生物制品批签发管理办法[EB/OL]. [20201211].https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20201221174641125. html
State Administration of market supervision Decree No. 33 of the State Administration of market supervision and administration measures for the administration of batch issuance of biological products [EB/OL]. [20201211]. https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/ 20201221174641125.html
[35] 张孝明, 杨振, 石大伟, 等.欧盟和美国血筛试剂批签发监管制度研究及启示 [J]. 中国药事, 2019,33(9): 1071
ZHANG XM, YANG Z, SHI DW, et al. Study on the supervision system of blood screening reagent batch issuance in the European Union and the United States and Its Enlightenment [J]. Chin Pharm Aff, 2019, 33(9): 1071
[36] 中国食品药品检定研究院. 2017年生物制品批签发年报[EB/OL]. [20180409]. https://www.nifdc.org.cn// nifdc/gzdt/ywdt/20180409155201736.html
National Institute for food and drug control. 2017 annual report on batch issuance of biological products [EB/OL]. [20180409]. https://www.nifdc.org.cn//nifdc/gzdt/ywdt/ 20180409155201736. html

来源:Internet


