您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-02 04:32
导语:机器人手术器械的再处理似乎是让无菌处理人员很头疼的问题。但了解机器人手术器械、它的再处理说明以及与厂商的沟通可以让这些问题并不那么难。
关键词
机器人手术器械,再处理,清洗,接受准则,无菌服务,灭菌
摘要
过去几年间,机器人辅助手术由于对病人、外科医生和医疗系统有诸多优势而得到了巨大的发展。可复用机器人手术器械可以增强外科医生对组织操作的控制,允许进入难以进入的解剖组织的复杂器械。然而,为了确保病人的安全,复杂的结构导致其清洗、消毒和灭菌需要特别的注意。
本文综述了机器人手术器械最佳去污技术,强调了在目前监管力度较高的环境中,制定和验证使用说明书(IFU)需考虑设计、技术、国际标准和当地实践,这是非常重要的。
我们将强调无菌服务部门/无菌处理人员在处理高科技器械的去污过程中要考虑的关键因素。最后,我们强调拥有明确的已验证的IFU的重要性,以及制造商与无菌服务人员尽早建立卓有成效的沟通。
介绍
自20世纪80年代末以来,微创手术(MAS)一直采用专用器械进行,在腹部的切口长度小且数量少,硬式内镜可以通过这些切口进入器官观察。
这种手术技术与传统的开放手术相比有许多优点,包括1:
减轻疼痛和不适
更快恢复正常活动
显著降低手术部位感染(SSI)的发生率
并发症率降低50%
减少切口疝的发生率
减少对术后麻醉剂的依赖
缩短住院时间
然而,尽管有这些优点,只有不到50%的患者有机会采用这种手术方法。这是因为微创手术的技术有较高困难。
我们希望机器人辅助腹腔镜手术(RALS)能克服传统微创手术的局限性,其铰链式器械、三维放大视野和控制元件使外科医生更容易操作。
机器人手术,或者机器人辅助手术,其实是MAS的另一种形式,只不过使用的是一种更复杂的工具。它利用一个工作站(或控制台),外科医生通过该工作站控制配备有专用手术器械和内镜摄像头的机械臂,进行手术仅需要手术团队的少量协助。外科医生能够做比传统技术更精确、更灵活和更可控的多种复杂手术。1985年,医生通过Puma 560机器人在脑活检中放置一根针;1988年,利用机器人在手术中帮助操纵膝盖。从2000年开始,机器人手术变得越来越普及,每年都有新的系统上市。

图1-现代医疗机器人的开端:
a)和b)Puma 560手术机器人(Unimation),
c)Versius手术机器人(CMR surgical)
机器人器械在许多方面与标准器械不同;它们在x、y和z轴上移动,由导线控制,有标准器械和电外科器械。再处理的最大挑战是它们不能被拆卸,需要特定的去污组合步骤。此外,有些再处理周期也有差异,需要无菌服务机构进行监测(再处理循环次数与临床使用次数不同,后者由机器人监测)。
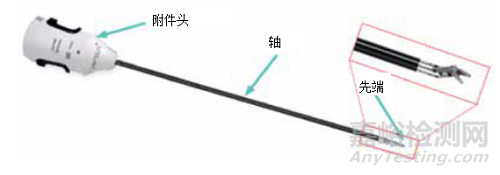
图2-CMR机器人器械的一般结构
机器人器械制造商的IFU也不同于常规器械。常规器械通常需要特定的使用地点护理/护理、初步手工清洗,然后自动清洗消毒或超声清洗,或进一步手工清洗和用反渗透(R/O)水漂洗。
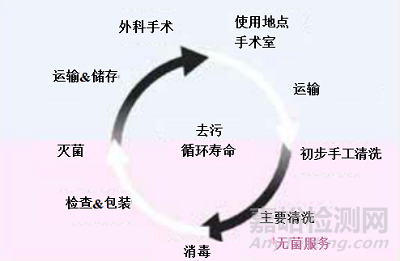
图3-复用医疗器械去污循环概述
好的IFU能与无菌服务部门的现有操作相适应,而不需要任何特殊程序或设备。说明书应表明对整个去污循环进行全面的验证,包括清洗剂类型、pH值、压力、温度和持续时间。此外,它们应该符合使用地区所执行的标准和规范。
不仅要考虑器械,还要考虑机器人手术系统中使用的内镜和电外科电缆。理想情况下,这些也应与无菌服务的现有操作相适应,不需要任何特殊程序或设备。由于普通器械和机器人器械存在差异,所以做好购买前咨询、购买后试用测试、专家培训、检索文献以及首次处理协助,对于确保彻底去除污染,避免患者受伤,是非常重要的。
以下各节将讨论制造商、供应商、再处理和灭菌专业协会以及灭菌服务人员应对再处理工作时,应进行的不同的思考。
机器人器械及再处理
再处理验证对可复用医疗器械的使用者和患者安全的重要性:医疗器械制造商负责医疗器械在其整个生命周期内的安全。IFU中的所有处理步骤必须经过国际标准和当地指南规定的验证程序。值得注意的是,尤其是对于机器人铰链式手术器械,人为因素(与无菌服务人员有关)应视为整个再处理验证的一部分;因此,IFU必须清晰、直接和明确。清洗验证方案必须模拟临床预期出现的残留物和污染物。
器械清洗后残留的污染物可能会影响消毒和灭菌效果,并且在器械重复使用时,如果传染给下一位患者,则会造成免疫反应和/或引起传染病的风险。因此,在变成法规要求之前,再处理说明的验证是一项关键的患者安全特征。
机器人腹腔镜关节器械处理和灭菌都有挑战:因为机器人手术器械的设计必须足够精细,颇具灵活性,以实现各种手术操作,一定程度的复杂性是无法避免的。这种复杂的设计可能造成特定的清洗和灭菌挑战,增加残留污染物的风险。
关节由机械线和滑轮控制,在临床使用过程中会受到污染。这些区域在手工清洗和检查时可能很难接触到。在电的作用下,用于切割、凝固、干燥、解剖和电灼的电外科器械给清洗过程带来了更严峻的挑战。当器械上的生物负荷暴露在电流下时会被烧灼,形成难以清洗的污染物;因此,在清洗验证研究期间重现这些最坏情况非常重要。
机器人器械通常包含管腔和管道;因此,在所有再处理步骤中,确保内表面通过端口与清洗溶液和漂洗水充分接触非常重要。
再处理质量从设计开始
到了设计阶段才对再处理进行测试和验证是不合理的。制造商在最初选择器械材料和设计时就应该考虑再处理要求。这就是我们所说的“以设计求质量”。
器械的设计应确保其安全有效的使用不会受到再处理(清洗、热消毒和灭菌)的影响。这包括考虑物理、材料和整个系统方面的考虑因素,确保重复的再处理循环不会损坏器械或影响其性能。
物理设计考虑因素:应尽可能减少难以接触的区域或结构,如铰链、裂缝和内腔。清洗和灭菌时必须考虑这些特征。例如,冲洗端口和内部管道设计时应确保可以通过安装冲洗端口进入内部表面。这些设计特点可防止清洗液体的滞留,以免对患者造成毒性影响。
应根据选定的灭菌方法选择器械的构造和材料。
材料设计注意事项:在预期的清洗步骤、化学品和灭菌条件下,为器械选择的材料应具有机械稳定性和惰性。器械的持续再处理不应导致有毒副产品的产生和释放。
机器人器械使用的不锈钢应具有耐腐蚀性和耐受相应再处理用品和方法的能力。应提醒使用者不要使用与器械和其他附件材料不兼容的化学品或液体。
如果在再处理过程中使用超声清洗,制造商应评估超声能量对器械中的螺钉、粘胶剂、连接件和涂层的影响。
生物安全注意事项:再处理应参与医疗器械生物相容性评估样品准备(与器械生产过程中使用的材料、添加剂和其他化学品有关的生物安全)。生物相容性测试必须在最终完成的经再处理的无菌器械上进行。可复用的机器人手术器械根据ISO 10993-1分类为:组织接触时间少于24小时的外部工具。因此,生物相容性评估指标是细胞毒性、致敏性、刺激性、急性全身毒性和热原性。
值得一提的是,清洗剂、消毒剂、润滑剂和灭菌剂的残留会对器械的整体生物相容性产生影响。因此,强烈建议使用哺乳动物细胞进行细胞毒性试验,作为再处理验证的一部分,以证明这些残留物没有相关风险。
再处理要求:从国际标准到当地实际
再处理验证的要求、方法和验收标准由国际标准规定。监管这些过程的两大组织为国际标准化组织(ISO)和医疗器械促进协会(AAMI),AAMI是美国国家标准协会(ANSI)认可的标准制定组织。
国际标准规定了基线要求,但每个国家/地区都有额外的本地指南,这些指南可能定义了额外的要求、测试方法,甚至是更严格的验收标准。例如德国的KRINKO(德国罗伯特科赫研究所的医院卫生和感染预防委员会)和英国的健康技术备忘录(HTM)01-01。即使这些指南基本原理相同,但也有不同之处,因此给新上市的可复用医疗器械带来了挑战。
此外,每家医院或无菌服务机构各自使用的规范和方案可能需要进一步调整IFU中制造商最初建议的再处理条件,来适应已有的流程。只有在进行了验证之后,才能进行这些操作。
再处理步骤:验证和技术考虑因素
机器人手术器械的典型再处理如图4所示。以下各部分介绍了每一步要考虑的关键因素。
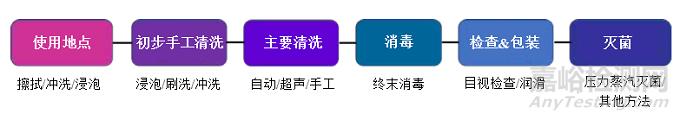
图片
图4-机器人手术器械再处理的典型推荐流程
器械分类:在开始验证前,制造商应根据器械的预期临床用途,将器械分为三个类别2(高度危险性、中度危险性或低度危险性)之一。根据器械分类,确定验证要求和验收标准。手术机器人器械通常被归类为高度危险性器械。
所有验证试验应在良好实验室管理规范(GLP)的条件下进行。强烈建议按照ISO 17025的要求认证每项测试的设施。
使用点护理和初始手工清洗:如前所述,由于机器人器械的复杂性和无法拆卸3,4,无菌服务人员清洗时有挑战。为了克服这一挑战,在任何主要清洗(手工、自动和/或超声)之前增加使用点护理和强化手工清洗步骤对于避免器械内和器械上的污染物干涸至关重要,因此有助于器械的后续清洗步骤(图5)。

图5-影响复用手术器械清洗效率的关键因素
主要清洗验证:用于手术机器人器械再处理的清洗方法包括全手工清洗或机械清洗,可使用超声波清洗机、自动清洗消毒机或两者兼有。这些方法可以通过使用经过验证的清洗剂给机器人器械进行清洗验证来进行评估。
世界卫生组织(WHO)强烈建议能耐受机械程序的医疗器械使用清洗消毒机,这样能增加与清洗剂的接触,降低无菌服务人员的潜在风险,消除人工处理过程中的不一致。此外,装有冲洗口的机器人手术器械需要配备冲洗管系统的清洗消毒机,因为在自动清洗循环中,清洗消毒机可以让清洗剂和冲洗水直接导入冲洗口来清洗管腔。
如果不选择自动清洗,则应考虑超声清洗。虽然这个要求并非强制,但先用清洗机清洗,后用超声清洗,或反过来,都是去除铰链器械上某些污染物堆积的有效方法。
由于多酶清洗剂能够有效地分解手术过程中积聚的生物油脂,因此相对于不含酶的清洗剂,多酶清洗剂被更多人选择。酶是一种生物催化剂,可以在清洗阶段使用较低的温度;pH值过低可能导致清洗不充分/无效,而pH值过高可能与器械材质不兼容。
清洗验证主要由以下国际标准规定:AAMI TIR30、ASTM E2314-03、ASTM F3208、ASTM F3293和ISO 15883系列。
清洗结束后,应进行目视检查,然后器械采样并进行分析,以量化污染物残留。至少应包括两个标记物(如血红蛋白、蛋白质、碳水化合物、内毒素)。清洗验证的最后一步是通过细胞毒性试验确定清洗剂残留。
清洗验证时,重要的是根据FDA指南和AAMI TIR30,在验证方案中指定验收标准。清洗方法的验收标准是无可见污染物,蛋白质水平<6.4μg/cm2和血红蛋白水平<2.2μg/cm2。
然而在德国(以及其他一些欧盟国家),当地指南中蛋白质残留水平验收标准可能更严格。5,6,7如果设计方面考虑不够周全以及没有严格遵循IFU,机器人手术器械可能很难达到这一更严格的要求。
消毒验证
化学消毒:不耐热消毒的器械可以用化学消毒剂进行消毒;包括邻苯二甲醛、戊二醛、过氧乙酸、过氧化氢、含氯化合物、酒精和二氧化氯。
热消毒:用清洗机做主清洗的另一个优点是清洗循环中有湿热消毒步骤,在此过程中,器械被暴露在经验证的预设温度和时间下,以达到所需的消毒水平。在检查和包装器械时,湿热消毒对于降低无菌服务人员的潜在风险非常重要。
A0方法:A0法是ISO 15883推荐使用的方法,能够评估是否达到湿热消毒效果(细菌减少6个对数值)。“A”定义为在80°C下产生特定消毒效果的等效时间(秒)。
A0=3000意味着80°C/50分钟或90分钟°C/5分钟
A0=600可通过80°C/10分钟,或90分钟°C/1分钟
根据HTM 01-01 D部分,湿热消毒验证要求A0值大于600。DGKH、DGSV和AKI指南要求高度危险性器械的热消毒A0值为3000或更高。
生物负荷法:生物负荷法也可以按照ISO 15883中列出的推荐评估方法进行。可以选择此方法来验证通过减少试验中使用的细菌6个对数值以上,实现高水平的消毒。德国和美国要求使用生物负荷法验证热消毒。
灭菌验证
灭菌方法的选择取决于产品的性质、预期用途以及器械设计和材料与不同灭菌剂的兼容性、将使用的设备以及器械的包装和储存方式。
可重复使用医疗器械的灭菌方法有多种;包括压力蒸汽灭菌、环氧乙烷(EO)灭菌、过氧化氢等离子灭菌、甲醛气体、臭氧和干热。各灭菌方法的适用范围、灭菌监测方法、优点和缺点都可以在WHO《医疗机构医疗器械的去污和再处理》指南中找到。
压力蒸汽灭菌通常是许多无菌服务的标准方法,对所有已知的活菌都非常有效。压力蒸汽灭菌是非常经济有效,安全,随时可用,可设置不同的循环。
灭菌方面的主要规范有:ISO 14937、ISO 17665、ANSI/AAMI ST79、AAMI ST67、ISO 17664、ISO 11737系列、FDA指南和ISO 11135。
ISO 14937给出了灭菌过程达到充分微生物杀伤力的最低温度和时间的几个例子:121°C 15分钟,126°C 10分钟134分钟°3分钟。ANSI/AAMI ST79通常建议暴露温度范围为132℃°C至135°C,对应不同的暴露时间。
各地指南可能要求验证额外的循环。例如,在法国、英国和其他一些欧盟国家,一个特定的循环(134°C-137°C,18分钟)称为朊毒体周期,应考虑帮助消除与朊毒体克雅氏病污染的风险。器械制造商有责任检查这些特定循环是否与器械设计和材料兼容,以及是否包含在器械验证研究中。
结论
机器人手术在医疗系统中越来越重要,确保所有患者都有机会从微创手术中受益,并降低医疗系统的成本。
相对而言,机器人手术仍处于起步阶段,并在不断发展。新的竞争对手的出现推动了产品的开发和普及。
机器人器械、内镜和相关的电外科电缆是否难以处理?不是
虽然机器人手术器械应融入消毒供应中心现有的标准设备和循环,但确实需要一些不同于标准器械的做法。再处理的最大挑战是不可拆卸,需要特定的去污方法。此外,部分有不同的再处理循环,需要消毒供应中心进行监测(再处理循环的数量与机器人监测的临床使用数量不同)。
它们需要特殊护理和注意吗?是的
从使用地点护理、初始手工清洗、清洗机的灌流、检查、润滑、压力蒸汽灭菌到再处理寿命可追溯性,所有步骤都有细微差别,对于如此复杂的器械来说,这并不奇怪;但是,所有这些都必须符合标准规范和程序。
以下是再处理机器人器械的关键成功因素:
明确的、全面的和适用的IFU;
IFU中包含完整的验证的所有步骤;
客户和制造商之间的早期交涉,商讨问题;
为所有员工提供专业教育(由无菌服务行业训练有素的专业人员提供)(由良好的支持文献支持);
由无菌服务行业训练有素的专业人员提供第一例和持续性支持;
客户参与和反馈,确保系统不断的可持续发展。
参考文献:
1. Cooper MA, Hutfless S, Segev DL, Ibrahim A, Lyu H, Makary MA et al. Hospital level under-utilization of minimally invasive surgery in the United States: retrospective review BMJ 2014; 349: g4198 doi:10.1136/ bmj.g4198.
2. U.S. Food and Drug Administration. Reprocessing medical devices in health care settings: validation methods and labeling.
3. Saito Y, Yasuhara H, Murakoshi S, Komatsu T, Fukatsu K, Uetera Y. Challenging Residual Contamination of Instruments for Robotic Surgery in Japan. Infect Control Hosp Epidemiol. 2017 Feb; 38(2):143-146.
4. Saito Y, Yasuhara H, Murakoshi S, Komatsu T, Fukatsu K, Uetera Y. Novel concept of cleanliness of instruments for robotic surgery. J Hosp Infect. 2016 Aug; 93(4):360-1.
5. Kremer TA, Patel A, Summers C, Quin M, Lemons K, McDonnell G. Protein residuals on reusable medical devices and patient safety impact. Zentr Steril 2019; 27 (3): 178–183
6. Guideline compiled by DGKH, DGSV and AKI for the validation and routine monitoring of automated cleaning and thermal disinfection processes for medical devices, Cent Steril 2017.
7. Germany: Federal Institute for Drugs and Medical Devices. Devices, Commission on Hospital hygiene and Infection Protection at the Robert Koch Institute and the Federal Institute for Drugs and Medical. Hygiene Requirements for the Reprocessing of Medical Devices. 2012.
8. World Health Organization. Decontamination and reprocessing of medical devices for healthcare facilities. 2016.
--译自Process 2021.7&8 P86
Reprocessing of Robotic Surgery Reusable Instruments
Insight into What’s Behind the Manufacturer Instructions for Use

来源:鲁沃夫CSSD国际论坛


