您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-01-18 13:00
我们在进行一个方法验证时,最好也必须准备一个方案,按照此方案进行相关实验,避免临时进行实验设计造成不必要的错误。此文将探讨一下有关物质验证的方案设计。
有关物质验证一般包括专属性、定量限(如果检测限满足报告阈值,按照ICH可以不进行检测限的验证)、线性和范围、方法精密度、准确度、中间精密度、耐用性(包括滤膜研究)和溶液稳定性。每一个验证实验均应满足系统适应性的要求。
不管是国内还是国外,产品有时有多个规格,所有规格都需要进行方法验证吗?答案是否定的,那么选用什么规格进行方法验证呢?例如,有X(小规格)、Y(中间规格)、Z(大规格)三个规格,一般三个规格最终供试品溶液浓度一致,建议按如下情况:
▍1. 当X、Y、Z为等比例处方
a.供试品溶液配制:称取相当于一定量(如100mg)的活性成分,则选用任一规格均可,一般选择最大Z或最小规格X。
b.供试品溶液配制:转移一定量的片(如5片或10片)至同一规格容量瓶,则选用最大规格Z;如果转移至不同规格容量瓶,母液浓度一致,则同1a。
▍2. 当X、Y、Z为等片重
a.供试品溶液配制:称取相当于一定量(如100mg)的活性成分,则选用最小规格(辅料最多)。
b.供试品溶液配制:转移一定量的片(如5片或10片)至同一规格容量瓶,则选用最大规格(原料药最多,考虑API/杂质溶解性的影响);如果转移至不同规格容量瓶,母液/最终浓度一致,则选用最小规格。
▍3. 当X与Y等比例处方,X与Z等片重
a.供试品溶液配制:称取相当于一定量(如100mg)的活性成分,对于X和Y规格,则选用任一规格均可;对于X和Z规格,同2a,则选用小规格X。因此,选用X规格。
b.供试品溶液配制:转移一定量的片(如5片或10片)至同一规格容量瓶,对于X和Y规格,选用大规格Y;对于X和Z规格,则选用最大规格Z,最终应该根据API溶解性和辅料影响选择。如果转移至不同规格容量瓶,母液浓度一致,对于X和Y规格,选用任一规格;对于X和Z规格,则选用最小规格X。因此,选用小规格X。
对于X、Y、Z的关系基本为以上关系,即使关系稍有不同也可参考上述进行规格选择。当然如果有更多规格时,且有些规格处方之间相似性较小时,选择2个规格进行方案验证有时也是必要的。
我们以主成分外标法为例,杂质限度假设如下表:
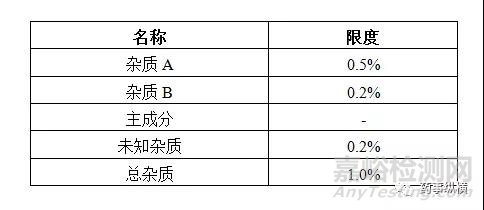
1.0溶液配制
a.供试品溶液:取20片称重,研磨均匀,精密称取相当于100mg 活性成分的粉末置于100mL容量瓶,加入稀释溶解,并定容至刻度,摇匀(如有必要需要超声)。(1mg/mL)
b.标准品溶液:精密称取20mg主成分标准品置于100mL容量瓶,加入稀释剂定容至刻度,摇匀。精密移取上述溶液5.0mL置于200mL容量瓶,加入稀释剂定容至刻度,摇匀。(5μg/mL)
c.建议配制灵敏度溶液:以报告阈值计算浓度,一般为0.05%或0.1%的供试品溶液。
2.0验证项目
系统适用性
专属性
定量限
线性和范围
精密度
准确度
中间精密度
耐用性
溶液稳定性
2.1系统适用性
序列设置
1针空白稀释剂(系统稳定后);
1针灵敏度溶液;
5针或6针标准品溶液Std
1针各供试品溶液
1针标准品溶液(每12小时或序列结束插入Std)
满足分离度、理论板数、拖尾因子、信噪比等要求;
满足5针或6针标准品溶液中主峰峰面积RSD的要求,满足序列中或末尾插入标准品溶液峰面积与前5针或6针主峰峰面积RSD的要求。
2.2 专属性
(1)空白溶剂、空白辅料和杂质干扰
按1.0溶液配制 配制空白溶剂、标准品溶液、供试品溶液。
空白辅料:精密称取相当于100mg活性成分的空白辅料粉末(如果不同规格,包衣粉不一致,各规格都需分别配制空白辅料)。
杂质A标准品储备溶液:精密称量10mg杂质A标准品置于200mL容量瓶,加入稀释剂溶解并定容,摇匀。(50μg/mL)
杂质B标准品储备溶液:精密称量10mg杂质B标准品置于100mL容量瓶,加入稀释剂溶解并定容,摇匀。精密移取上述溶液10.0mL置于50mL容量瓶,加入稀释剂定容至刻度,摇匀。(20μg/mL)
混合溶液:精密称取相当于100mg 活性成分的粉末置于100mL容量瓶,分别移取上述杂质标准品储备溶液10.0mL,加入稀释溶解并定容至刻度(如有必要需要超声)。
序列设置:
1针空白稀释剂(系统稳定后);
1针灵敏度溶液;
5针或6针标准品溶液Std
杂质A标准品储备溶液
杂质B标准品储备溶液
1针混合溶液
1针标准品溶液(每12小时或序列结束插入Std)
接受标准:
a.空白溶剂和空白辅料对主成分、杂质A和杂质B无干扰;
b.混合溶液中,主成分、杂质A和杂质B峰与相邻杂质峰之间的分离度大于1.5。采用PDA/DAD检测器,主成分、杂质A和杂质B峰峰纯度角小于纯度阈值,或峰纯度因子大于995。
(2)强降解实验
注:(1)选用PDA/DAD检测器,选用200nm-400nm波长。
(2)一般至少有一个破坏条件产生杂质的量在5-20%,如果降解条件比较剧烈使大部分原料发生降解,应采用温和条件或缩短时间再进行试验;如果最剧烈的条件下,降解的杂质量仍小于5%,说明活性成分比较稳定,无需采用更剧烈的条件。
溶液破坏:
未破坏条件样品
加热条件破坏样品:一般溶液60℃水浴加热
酸性条件破坏样品:一般采用0.1mol/L-1.0mol/L盐酸
碱性条件破坏样品:一般采用0.1mol/L-1.0mol/L氢氧化钠
氧化条件破坏样品:一般采用0.1%-3%过氧化氢,中性条件下破坏7天。
光照射条件破坏样品:至少照射1.2×106 Lux*h,紫外能量不低于200w*h/m2
固体破坏:
高温高湿条件破坏样品:建议50-60℃(高于加速试验温度10℃),相对湿度75%或更高。
光照条件破坏样品:至少照射1.2×106 Lux*h
对于国内申报,可以不做固体破坏(因有影响因素试验5天/10天)
接受标准:
a.破坏样品溶液和未破坏样品溶液中,主成分与相邻杂质峰之间的分离度大于1.5。采用PDA/DAD检测器,主成分峰纯度角小于纯度阈值,或峰纯度因子大于995。
b.物料平衡在90%-110%,如果不平衡给出合理的解释。
2.3 定量限
以报告阈值或小于报告阈值作为定量限,根据ICH日剂量大于1g,报告阈值为0.05%;日剂量小于等于1g,报告阈值为0.1%。当定量限大于报告阈值时,一般可认为方法的灵敏度较低,但如果杂质限度远大于报告阈值,小编认为也可以接受。
接受标准:
a.6针定量限溶液的相对标准偏差(RSD)不得过15%;
b.主成分、杂质A和杂质B的信噪比不小于10。
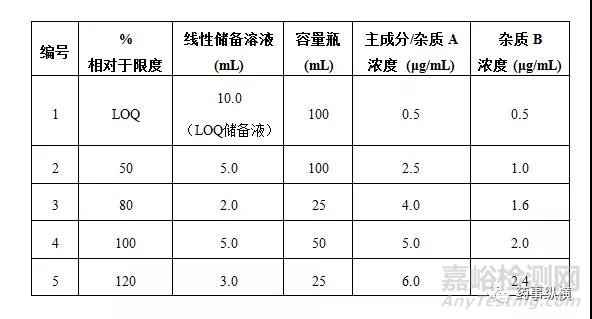
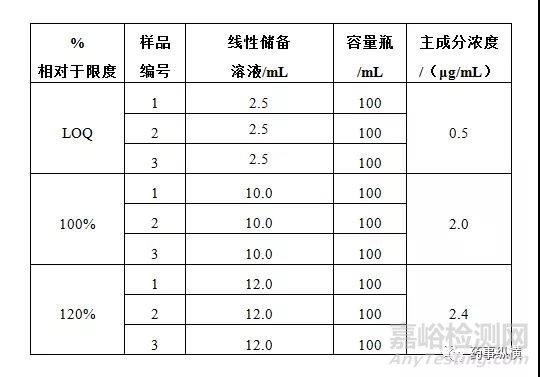
2.4 线性和范围
杂质A溶液:精密称量12.5mg杂质A标准品置于50mL容量瓶,加入稀释剂溶解并定容,摇匀。(250μg/mL)
杂质B溶液:精密称量10mg杂质B标准品置于100mL容量瓶,加入稀释剂溶解并定容,摇匀。(100μg/mL)
主成分工作标准品溶液:精密称量12.5mg主成分标准品置于50mL容量瓶,加入稀释剂溶解并定容,摇匀。(250μg/mL)
线性储备溶液:分别取上述溶液各10.0mL至50mL容量瓶中,稀释剂定容至刻度,摇匀。
LOQ储备溶液:分别取上述杂质A溶液和主成分溶液各1.0mL,杂质B溶液2.5mL至50mL容量瓶中,稀释剂定容至刻度,摇匀。
一般配制从定量限至120%或150%限度浓度的溶液。按照下表进行线性溶液制备。
接受标准: 相关系数大于0.9900。
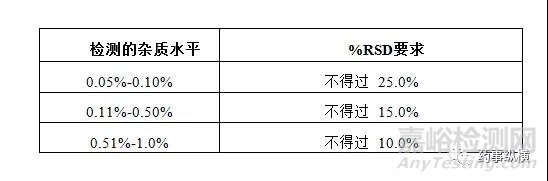
2.5 精密度
制备6份供试品溶液,如果供试品溶液中杂质A或杂质B含量小于报告阈值,需制备6份100%添加样品溶液,考察方法的精密度。
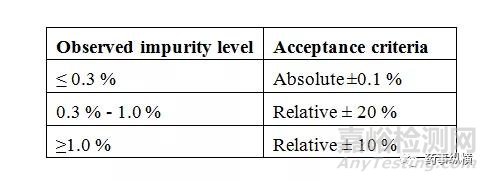
接受标准:杂质A、杂质B、最大未知杂质(大于报告阈值)和总杂质的相对标准偏差满足下表。
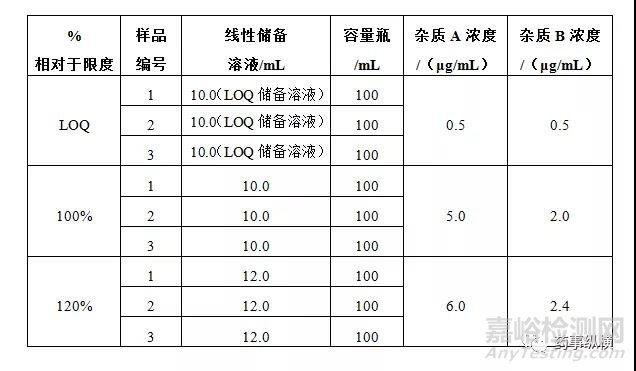
2.6 回收率
制备3个水平准确度溶液,分别为LOQ×3,100%×3和120%×3。通过样品粉末或辅料空白中添加一定量的杂质标准品溶液或主成分标准品溶液,考察方法的准确度。
(1)已知杂质准确度
使用2.4线性和范围项下LOQ储备溶液和线性储备溶液,精密称取相当于100mg 活性成分的粉末置于100mL容量瓶,按下表加入相应量的标准品溶液,其他同供试品溶液处理。
接受标准:
a. 杂质A回收率在90%-110%范围内,相对标准偏差不得过10%。
b. 杂质B回收率在80%-120%范围内,相对标准偏差不得过10%。
(2) 未知杂质准确度
主成分标准品溶液:精密称量10mg活性成分标准品置于50mL容量瓶,加入稀释剂溶解并定容,摇匀。精密移取上述溶液10.0mL置于100mL容量瓶,加入稀释剂定容至刻度,摇匀。(20μg/mL)
精密称取相当于100mg 活性成分的空白辅料粉末置于100mL容量瓶,按下表加入相应量的标准品溶液,其他同供试品溶液处理。
接受标准:活性成分回收率在80%-120%范围内,相对标准偏差不得过10%。
2.7 中间精密度
由第二个实验者在不同天采用不同的色谱柱、不同液相色谱等,采用同一批号的样品进行中间精密度实验。
制备6份供试品溶液,如果供试品溶液中杂质A或杂质B含量小于报告阈值,需制备6份100%添加样品溶液,考察方法的中间精密度。
接受标准:
a.杂质A、杂质B、最大未知杂质(大于报告阈值)和总杂质的相对标准偏差满足2.5项下表格。
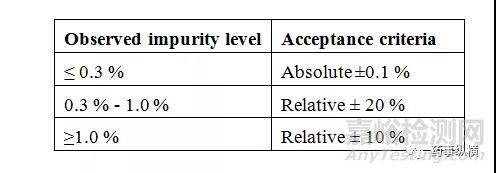
b.两个分析者测定杂质A、杂质B和最大未知杂质(大于报告阈值)相对偏差满足下表。
2.8 耐用性
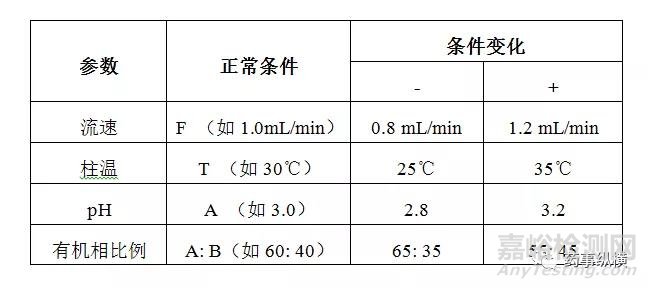
(1) 通过变动色谱柱、柱温、流速、缓冲盐pH和有机相比例等考察方法的耐用性。
(2)根据稀释剂的性质,选择至少两种滤膜考察不同滤膜的影响,收集第1mL、2mL、3mL、4mL和5mL,如果还不满足标准,需继续进行。
制备标准品溶液和供试品溶液,如果供试品溶液中杂质A或杂质B含量小于报告阈值, 需采用100%添加样品溶液代替供试品溶液,考察方法的耐用性。
接受标准:
a.满足系统适用性要求。
b.各条件下测定杂质A、杂质B和最大未知杂质(大于报告阈值)与正常条件下结果的偏差满足下表。
2.9 溶液稳定性
配制标准品溶液和供试品溶液(如果杂质A或杂质B含量小于报告阈值,建议采用100%添加溶液)在室温和冷藏条件下在0h、12h、24h和48h考察样品溶液的稳定性。
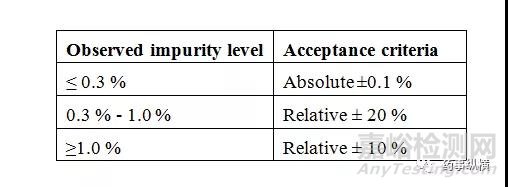
接受标准:各时间下测定杂质A、杂质B和最大未知杂质(大于报告阈值)与正常条件下结果的偏差满足下表。
3.0结语
此方案设计的观点不代表官方观点。本文是小编根据ANDA项目研发经验和多个产品FDA回复意见总结设计。

来源:Internet


