您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-04 09:51
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.艾伏尼布注册研究达临床终点。基石药业“first-in-class”口服IDH1抑制剂艾伏尼布(ivosidenib)在中国的注册研究CS3010-101达到预期终点。在携带IDH1突变的中国复发或难治性急性髓系白血病(R/R AML)患者中,艾伏尼布显示了明确的疗效和可控的安全性,且与全球研究人群中的疗效和安全性数据基本一致。具体数据将于学术会议上公布。目前,艾伏尼布用于上述适应症的新药上市申请(NDA)已获CDE受理,并获CDE拟纳入优先审评。
2.加科思JAB-21822国内启动临床。加科思药业自主研发的1类创新药JAB-21822在中国开展的I/II期临床首例患者给药。该项研究旨在评价JAB-21822用于KRAS G12C突变的晚期实体瘤的安全性、耐受性。JAB-21822是该公司利用变构抑制剂技术自主研发的一款小分子KRAS G12C抑制剂,目前正在中美同步展开针对非小细胞肺癌、结直肠癌和其他实体瘤的临床试验。
3.君境生物XPO1抑制剂启动临床。苏州君境生物XPO1抑制剂WJ01024首次登记启动临床。这是一项Ⅰ期临床,评价WJ01024在晚期肿瘤患者中口服给药剂量递增和剂量扩展的安全性、耐受性、药代动力学和初步疗效。JS110特异性阻断XPO1蛋白功能,抑制包括p53在内多种抑癌蛋白出核,加强抑癌蛋白功能。在肿瘤动物模型中,JS110单药或者联用可抑制多种血液和实体肿瘤生长。君实拥有JS110的全球权益。
4.天境治疗AD新药获FDA临床许可。天境生物拟用于治疗阿尔兹海默症(AD)的在研新药Protollin获FDA批准,即将开展Ⅰ期临床研究。Protollin是哈佛医学院附属布莱根医院(BWH)和Inspirevax公司合作开发的一种由细菌的外膜蛋白和脂多糖(LPS)组成的、能刺激机体先天免系统的新型免疫制剂。临床前数据表明,Protollinf具有通过刺激机体先天免疫系统,以清除导致记忆缺失的病理性β-淀粉样蛋白及tau蛋白。
5.治疗戈谢病项目CAN103国内报IND。北海康成治疗戈谢病的CAN103项目临床试验申请(IND)获CDE受理。CAN103是一种酶替代治疗药物,拟开发用于成人和儿童I型和III型戈谢病患者的长期治疗。近30年来,临床试验和真实世界的支持数据表明,戈谢病经葡萄糖脑苷脂酶替代疗法(ERT)治疗, 其主要非神经系统症状和健康相关的患者生活质量均有显著改善。
国际药讯
1.阿斯利康红斑狼疮新药获FDA批准。阿斯利康宣布其“first-in-class”I型IFN受体拮抗剂Saphnelo(anifrolumab-fnia)获FDA批准上市,联合标准疗法,用于治疗中重度系统性红斑狼疮。在两项临床研究中(TULIP和MUSE),与安慰剂相比,更多接受Saphnelo联合标准治疗的患者经历了器官系统(包括皮肤和关节)总体疾病活动的减少,并实现了口服皮质类固醇(OCS)使用的持续减少。Saphnelo用于治疗SLE也正在欧盟和日本接受监管审评。
2.施维雅IDH1抑制剂达Ⅲ期临床主要终点。施维雅IDH1抑制剂Tibsovo(ivosidenib)一线治疗IDH1突变的急性髓系白血病(AML)的国际Ⅲ期临床AGILE结果积极。与Azacitidine联合安慰剂相比,Tibsovo联合Azacitidine治疗的患者EFS(无事件生存期)出现统计学意义的显著改善。该试验同时达到所有关键的次要终点,包括完全缓解率(CR率)、总生存率(OS)、CR和完全缓解,以及部分血液学恢复率(CRh率)和客观缓解率(ORR)。试验中,这一组合的安全性与已知数据一致。
3.渤健Tysabri治疗RRMS的Ⅲ期临床积极。渤健评估Tysabri(natalizumab)Q4W IV 300mg方案与Q6W IV 300mg给药方案相比,治疗复发缓解型多发性硬化(RRMS)的Ⅲb期NOVA研究结果积极。2个治疗组第72周新的或新扩大的T2高信号病变的平均数量为0.05和0.20(p=0.0755),差异不具统计学意义;每组出现新的或新扩大的T2病变的患者比例分别为4.1%和4.3%。来自TOUCH研究的最新数据分析表明,与批准的Q4W IV方案相比,平均Q6W给药方案与PML概率降低88%相关(危险比0.118,p<0.0001)。
4.肌减少症新药Ⅱ期临床积极。Biophytis公司蜕皮激素Sarconeos (BIO101)治疗肌肉减少症的Ⅱ期临床获顶线结果。最高剂量组(350 mg bid)治疗6个月后,FAS(全分析集)组患者的步速为0.09m/s,PPS(符合方案集)组的步速为0.10 m/s(p<0.01);350 mg bid时Sarconeos的作用接近肌减少症(0.1 m/s)的最小临床重要性差值(MCID),可显著降低老年人的活动障碍和死亡率。临床中,Sarconeos组和安慰剂组的不良事件等发生率没有显著差异。
5.安斯泰来拟合作开发创新细胞疗法。Minovia Therapeutics与安斯泰来达成一项全球性战略合作,利用安斯泰来基因工程改造的诱导多能干细胞(iPSC),并使用Minovia专有的线粒体增强疗法(MAT)技术平台加以改良,共同开发和商业化治疗线粒体功能障碍相关疾病的新型细胞疗法。根据协议,Minovia将获得2000万美元的预付款,以及每个候选产品可能最高达4.2亿美元的开发、监管和商业化里程碑付款。
6.益普生联手Exicure开发罕见神经疾病SNA疗法。益普生与Exicure达成独家许可协议,将利用Exicure专有的三维球形核酸(SNA)平台技术,联合开发治疗罕见神经疾病的新疗法。研究表明,SNA可以增强寡核苷酸的细胞渗透、生物分布和器官持久特性,这将有助于调节基因表达。根据协议,Exicure将获得2000万美元的预付款,可能高达10亿美元的期权行权费和里程碑付款;Exicure将负责新疗法的发现以及临床前的开发工作。
医药热点
1.北京一诊所严重违反防疫规定被注销。北京丰台卫健委日前发布关于注销北京韩翠芬诊所《医疗机构执业许可证》的通报。据了解,该诊所为逃避北京市医疗卫生机构内部员工定期进行核酸检测的相关规定,自2021年5月起已陆续向第三方检测机构提供未经实际采样的内部员工虚假咽拭子样本30余份进行检测,骗取核酸检测阴性报告,2021年7月31日,丰台区卫健委依法注销该诊所《医疗机构执业许可证》。
2.上海新增“独立”本土新冠病例。8月2日,上海浦东机场货运区一名53岁男性外航货机服务人员新冠检测呈阳性,其职业为驾驶员,负责外航货机机组浦东机场闭环运送。该病例曾于7月21日和7月28日进行例行核酸检测,两次结果均为阴性。据悉经连夜排查,截至8月3日9时,已排查到该病例的密切接触者52人和密接的密接250人,全部落实集中隔离措施,首次核酸检测结果均为阴性。
3.271个药品通过新版医保目录初审。7月30日,国家医保局发布《2021年国家医保药品目录调整通过初步形式审查的申报药品名单》,共计271个药品通过初步形式审查,其中2016年以后新上市的药品占93.02%。经统计,共有58类抗肿瘤药物纳入2021版国家医保药品目录初审名单。
4.3家中国药企跻身《财富》世界500强。2021年《财富》世界500强排行榜发布,今年500强排行榜企业的营业收入约为31.7万亿美元,比去年下降5%。进入排行榜的最低销售收入也从254亿美元下降到240亿美元。据统计,共有19家药企进入500强名单之列,华润、强生、国药集团分别排制药企业的第一、第二、第三名;营收分别达99437.6百万美元、82584百万美元以及77278.2百万美元。此外进入500强排行榜的中国药企还有广药集团。
审评动向
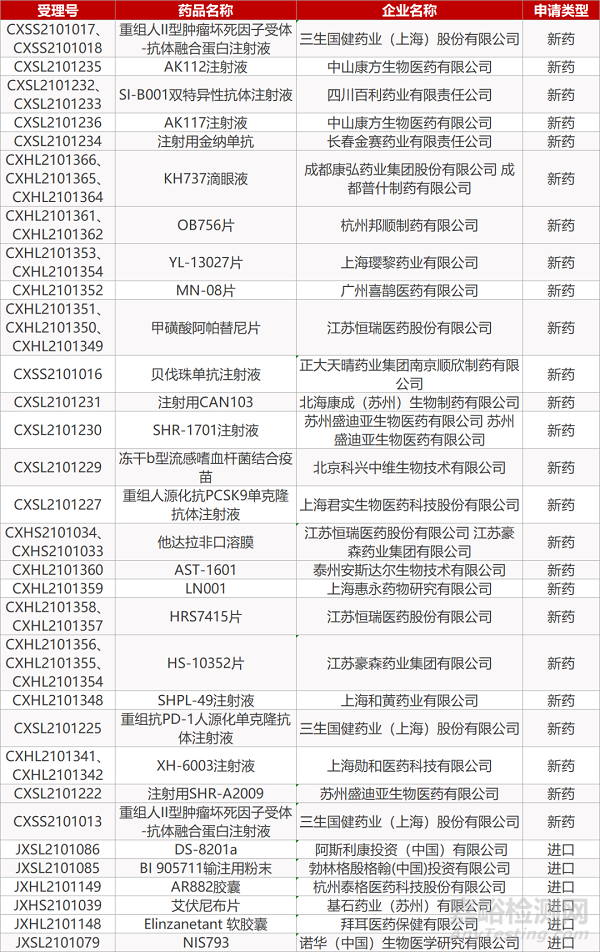
1. CDE新药受理情况(08月03日)

来源:药研发


