您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2021-05-25 11:21
2021年5月, 国家局发布了2次关于飞检,导致停产整改及产品召回的公告。国家药监局发布停产整改的通告(2021年第31号),公告明确被飞检企业质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范,而采取的直接措施是立即停产整改,并根据评估对于可能导致安全隐患的产品实施召回。
医疗器械飞行检查情况通告 (2021年第1号),核查中心于2021年3月组织开展了医疗器械生产企业飞行检查工作,发现江西国康实业有限公司等4家企业存在一般项目不符合《医疗器械生产质量管理规范》及相关附录要求;河南省华裕医疗器械有限公司等4家企业(检查前已停产)存在关键项目不符合《医疗器械生产质量管理规范》及相关附录要求。
什么是飞检?
《药品医疗器械飞行检查办法》局令第14号
针对药品和医疗器械研制、生产、经营、使用等环节开展的)不预先告知的监督检查。
相关法规:
《医疗器械监督管理条例》
《药品医疗器械飞行检查办法》
《医疗器械生产监督管理办法》
《医疗器械生产质量管理规范》及其附录
《医疗器械飞行检查工作规范》
检查原则:依法独立、客观公正、科学处置、风险管控、问题导向、结果公开
开展药品医疗器械飞行检查的情形:
(一)投诉举报或者其他来源的线索表明可能存在质量安全风险的;
(二)检验发现存在质量安全风险的;
(三)药品不良反应或者医疗器械不良事件监测提示可能存在质量安全风险的;
(四)对申报资料真实性有疑问的;
(五)涉嫌严重违反质量管理规范要求的;
(六)企业有严重不守信记录的;
(七)其他需要开展飞行检查的情形。
处置原则:
一般性问题,限期整改
严重性问题,停产整改(发告诫信、约谈被检查单位、监督召回产品、收回或者撤销相
关资格认证认定证书,以及暂停研制、生产、销售、使用等风险控制措施。风险因素消
除后,应当及时解除相关风险控制措施)
违法违规行为:立案查处
2020 飞行检查情况
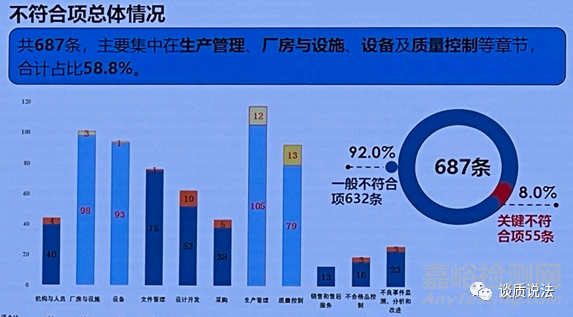
问题集中在生产管理、厂房与设施、设备及质量控制等环节,与2019年问题集中点基本一致。
生产管理/质量控制:没有建立相关规程或未按照规定程序进行生产。
如:企业未完全按照经注册的产品技术要求组织生产。
不符合《规范》企业应当按照建立的质量体系进行生产,以保证产品符合强制性标准和经注册或者备案的产品技术要求;
企业未按产品生产工艺规程中的规定记录温度;只在设计开发过程中验证pH值,在日常生产过程中未对pH进行监控和记录
企业进货检验,过程检验和成品检验的检验记录中,仅有结果记录,缺少原始数据图或计算过程。
企业未建立《产品放行程序》,声称《成品检验控制程序》即为产品放行程序,但该程序文件未规定产品放行条件和放行标 准,未明确产品放行人员的职责,不符合《规范》企业应当规定产品放行程序、条件和放行批准的要求。
厂房与设施:厂房与设施不能满足产品生产要求。
如:包材库屋顶有渗水现象;
危险品库面积不能满足实际需要;
洁净室等级温湿度 压差等无相关记录,
2021年第一批医疗器械飞行检查情况
(数据来源:检查中心2021年第一批医疗器械飞行检查情况汇总)
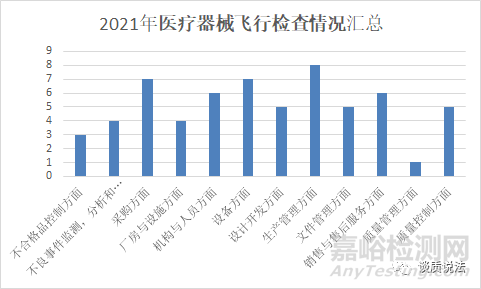
问题分布点: 生产管理方面,采购方面,设备方面,机构与人员方面, 另外突出设计开发方面,销售与售后服务方面 ,不良事件监测等。
问题分析:
机构与人员方面 (人员基本素质不够)
a.查看质量部负责人任职资格要求并现场询问,质量部经理晏某兼任销 售市场相关工作,不熟悉医疗器械相关法律法规和标准以及质量体系管理工 作。(专业的事,需要专业的人做)
b.未提供生产部负责人的产品生产相关专业能力相关文件。(不能证明,即可认为不具备)
设计开发方面(变更未在识别、评估,验证,确认后实施)
a.医用防护口罩于 2020 年 6 月份进行设计变更,但企业未能提供产品 设计和开发变更记录;未能提供产品设计和开发变更审评、验证和确认记录。
b.医用外科口罩用熔喷布在更换原料供应商后,未对设计开发变更进行 评审验证确认。
c.医用一次性防护服贴条工序的工艺参数温度、速率,红外额温计关键 工序校准调试的温度发生变更,企业未对设计开发更改(工艺参数变更)进 行识别并保持记录。
采购方面(未能按照程序文件规定执行)
a.未查见企业对供应商变更的控制和程序文件;企业《采购管理规程》 规定:“对 A 类物料的供应商要进行实地考察,填写《供方调查评价表》”, 查企业《供方调查评价表》未见对 A 类物料的供应商实地考察项目、内容, 在有关文件中也未查见对供应商实地考察的具体要求。
b.采购控制程序规定“合格供方名录”应由总经理批准,实际为采购经 理批准。
c.关键原材料熔喷布和纺粘法非织造布(SS 布)未明确验收准则等采购 要求。
不良事件监测、分析和改进方面(意识不够)
a.企业未按现行《医疗器械不良事件监测和再评价管理办法》的规 定对不良事件管理程序文件进行修改,更新不良事件报告、处置程序和处置 时限等要求;检查时发现该企业的一次性使用医用口罩产品自 2019 年 12 月 起有 19 例不良事件仍未评价。
b.企业不良事件监测人员黄某对医疗器械不良事件监测情况汇总分析 上报要求不熟悉,现场未查见不良事件汇总分析相关记录。
c.企业针对医用外科口罩的口罩带断裂强力抽检不合格问题,采取的 整改措施为对文件管理人员进行《质量记录管理制度》培训,未采取有效的 纠正措施。
总结:
关于整改,几点建议如下。
1. 启动纠正预防措施(CAPA)按照纠正预防措施相关流程,确保调查的充分性,及纠正预防措施的有效性。
法规依据:规范第七十四条 企业应当建立纠正措施程序,确定产生问题的原因,采取有效措施,防止相关问题再次发生。应当建立预防措施程序,确定潜在问题的原因,采取有效措施,防止问题发生。
2. 从质量体系层面出发,确保质量体系能够覆盖规范及适用的现场检查指导原则的要求。
3. 配备专业性人员。确保专业的人做专业的事,且有法可依。这里的“法” 就是指方法,程序文件,作业指导书。
4. 配备专业设备及资源。
应对飞检不是目的, 长期可持续发展,终究要有专业的人在充分的硬件环境下依据符合法规要求的质量体系(方法)做事。
确保医疗器械安全有效是每一位从事医疗器械行业从业者的使命。

来源:谈质说法


