您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-13 11:46
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
万春医药首创GEF-H1激活剂拟纳入优先审评。万春医药注射用普那布林浓溶液的上市申请获CDE拟纳入优先审评,针对的适应症为成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症。普那布林是一种“first-in-class”GEF-H1激活剂,万春医药已于今年3月在中美同步提交了新药上市申请(NDA)。值得一提的是,该新药去年9月分别获得NMPA和FDA授予的突破性疗法认定。
国内药讯
1.智翔医药PD-L1单抗启动Ⅲ期临床。智翔医药PD-L1单抗GR1405注射液登记启动一项Ⅲ期临床,评估GR1405联合GP化疗方案(吉他西滨+顺铂)一线治疗复发或转移性鼻咽癌的安全性和有效性,中国医学科学院肿瘤医院石远凯教授将担任主要研究者。这是GR1405开展的第五项临床研究。此前,智翔医药启动了GR1405联合化疗一线或二线治疗晚期三阴性乳腺癌的Ⅰb/Ⅱ期临床研究,以及GR1405治疗晚期鼻咽癌、头颈鳞癌等患者的Ⅱ期临床试验。
2.康方启动PD-1/VEGF双抗多项临床研究。康方生物新型肿瘤免疫治疗药物AK112日前登记启动了多项单药或联合用药的临床试验。AK112是一款PD-1/VEGF双抗。PD-1抗体与VEGF阻断剂的联合疗法已在多种瘤种中显示出疗效,如肾细胞癌、非小细胞肺癌和肝细胞癌。鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比,AK112可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。
3.华东医药荧光示踪剂国内获批临床。华东医药与MediBeacon联合申报的1类新药MB-102注射液(Relmapirazin)获CDE临床试验默示许可,用于检测肾小球滤过率。MB-102是一种用于测量肾小球滤过率的荧光示踪剂,通过该公司全球首创的TGFR动态监测系统无创监测MB-102产生的荧光信号随时间的改变,可实时、动态反映GFR,供临床医生对患者的肾功能进行即时评估及诊断。目前MB-102已在美完成探索性Ⅰ期和Ⅱ期临床试验。
4.欧康维视低浓度阿托品滴眼液申报III期临床。欧康维视生物宣布其核心产品OT-101(0.01%硫酸阿托品滴眼液)在中国提交的III期临床试验申请已获CDE受理。OT-101是欧康维视自主研发的一款0.01%低浓度硫酸阿托品滴眼液,拟用于治疗儿童和青少年近视进展。如果正式获批临床,OT-101将成为低浓度阿托品及其类似物全球首个包含中国人群在内的III期国际多中心临床试验(MRCT)。
5.复宏汉霖获BRAF抑制剂独家许可。复宏汉霖宣布与苏州润新生物达成一项独家合作,获得润新生物一款抗肿瘤新药BRAF V600E抑制剂HLX208(RX208)在中国(包括香港、澳门和台湾地区)进行开发、生产、商业化及再许可等的权利。RX208已在I期临床中显示出初步疗效。根据协议,润新生物将获9,750 万元首付款、金额不超过10.775 亿元的监管及商业销售等里程碑付款,以及产品的销售分成。
6.艾美斐生物完成A轮融资。艾美斐生物宣布完成2亿元人民币的A轮融资。本轮融资由领承创投、君实生物联合领投,新丝路金控跟投,汉能投资担任本轮融资的独家财务顾问。据悉,艾美斐生物拥有超过10款创新药的研发管线,目前正围绕两个候选分子IPG1094与IPG7236开展7个项目IND中美双报,今年预计有多项临床研究在中、美、澳多地开展。融资资金将用于推动主要候选品种的临床研究和支持后续管线的研发等。
国际药讯
1.新冠疫苗针对印度突变株中和效力数据公布。美国Emory大学的Mehul Suthar组在bioRxiv上传了Moderna新冠疫苗mRNA-1273和辉瑞疫苗BNT162b2针对印度突变株B.1.617的中和活性研究数据。研究发现康复者血清FRNT50从对标准株WA1的514下降到了对B.1.617活病毒的79,下降6.5倍;mRNA-1273接种者血清从对WA1的1332下降到对B.1.617的190,下降7倍;BNT162b2接种者血清从对WA1的1176下降到对B.1.617的164,下降7倍。但研究发现,两种mRNA疫苗接种者血清对B.1.617依然有显著中和活性;绝大部分康复者血清样本对B.1.617具有中和活性。
2.安进首创哮喘新药报BLA。安进与阿斯利康联合开发的潜在“first-in-class”TSLP抗体药物Tezepelumab已向FDA提交了生物制剂许可申请(BLA),用于治疗重度哮喘。在一项关键性Ⅲ期临床NAVIGATOR中,与安慰剂相比,该新药将重度哮喘患者的年平均哮喘急性发作率(AAER)降低了56%(p<0.001);不论基线嗜酸性粒细胞计数多少,tezepelumab均能够显著降低AAER。FDA已授予Tezepelumab突破性疗法称号。在中国,Tezepelumab用于重度哮喘和重度慢性鼻窦炎伴鼻息肉的III期临床正在进行中。
3.功能性治愈HSC基因疗法疗效积极。Orchard Therapeutics公司自体造血干细胞(HSC)基因疗法OTL-101治疗腺苷脱氨酶缺乏症导致的严重联合免疫缺陷患者(ADA-SCID)的Ⅰ/Ⅱ期临床数据在《新英格兰医学杂志》(NEJM)上发表。试验结果显示,患者在接受一次OTL-101治疗后2-3年的生存率为100%,超过95%的患者无需使用其它疗法来控制他们的病情。OTL-101此前已获FDA和欧盟EMA用于治疗ADA-SCID的孤儿药资格,以及FDA的突破性疗法认定和罕见儿科疾病认定。
4.辉瑞坚决反对放弃新冠疫苗知识产权。辉瑞/BioNTech新冠mRNA疫苗是西方国家广泛使用的一款疫苗。辉瑞CEO阿尔伯特伯拉日前向公司员工发布一封公开信,宣布坚决反对放弃新冠疫苗知识产权。阿尔伯特伯拉认为,放弃知识产权会“威胁”到疫苗原材料的流通,给生产“安全”和“有效”的辉瑞疫苗所必需的关键产能输出造成阻碍;辉瑞已投入20亿美元研发费用,未来小厂加入后,没有知识产权保护的投入将得不到保障等。
5.礼来联手MiNA公司开发小激活RNA(saRNA)疗法。礼来宣布与MiNA Therapeutics达成一项全球研究合作,利用MiNA专有的小激活RNA(saRNA)技术平台开发新型候选药物。根据协议,MiNA将为礼来所选定的5个靶标设计和筛选候选药物;礼来将负责候选药物的临床前和临床开发,并保留合作产品的独家商业化权利;MiNA将获2500万美元的预付款、潜在的里程碑付款,以及产品的销售分成。每个靶标总额高达2.45亿美元,此次合作的总价值高达12.5亿美元。
医药热点
1.上海首家公立医院癫痫中心成立。上海交通大学医学院附属瑞金医院癫痫中心日前揭牌成立,癫痫外科领域知名专家徐纪文教授将作为癫痫中心主任加盟瑞金。据悉,该癫痫中心是瑞金脑病中心成立的首个临床中心,瑞金医院旨在通过脑病中心这一平台,借助创新的体制机制,推动癫痫疾病的临床诊疗和神经科学研究齐头共进,打造瑞金新的王牌。瑞金医院癫痫中心也是上海三甲医院首家癫痫单疾病诊疗中心。
2.巴西变异新冠病毒株高达110种。截至当地时间5月11日,巴西权威医疗研究机构奥斯瓦尔多·克鲁兹基金会的基因组数据统计显示,该国在新冠疫情期间,经病毒基因组谱系分析,已检测出110种在巴西境内传播的变异新冠病毒毒株。当地媒体今年4月初曾报道巴西境内当时检测出92种变异新冠病毒株,而今35天里后,巴西医疗检测机构再度检出18种变异新冠病毒株,意味着新冠病毒在加速变异。
3.阿斯利康6月底前需交付欧盟1.2亿剂新冠疫苗。一名欧盟代理律师周二透露,欧盟同意阿斯利康推迟3个月履行新冠疫苗合同,但前提是阿斯利康在6月份之前交付1.2亿剂新冠疫苗。阿斯利康与欧盟最初达成的合同规定6月底前阿斯利康向欧盟交付3亿剂新冠疫苗,但目前为止仅交付5000万剂。4月下旬,欧盟已就延迟疫苗交付起诉阿斯利康违反采购协议。
审评动向
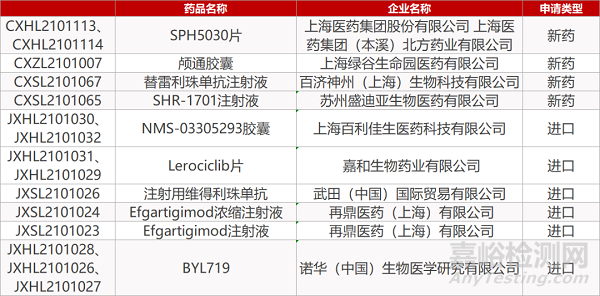
1. CDE新药受理情况(05月12日)
申请临床:
上海医药/上海医药集团(本溪)的SPH5030片(2个规格)、上海绿谷的颅通胶囊、百济神州的替雷利珠单抗注射液、苏州盛迪亚的SHR-1701注射液、上海百利佳生的NMS-03305293胶囊(2个规格)、嘉和生物的Lerociclib片(2个规格)、武田的注射用维得利珠单抗、再鼎医药的Efgartigimod浓缩注射液和Efgartigimod注射液、诺华的BYL719(3个规格)。
申请生产:
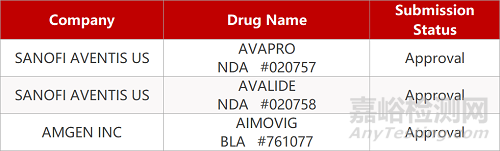
2. FDA新药获批情况(北美05月11日)

来源:药研发


