您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-07 16:00
目前全球疫情有2个特点,一方面,中美欧等国家地区积极进行新冠疫苗的接种,另一方面,印度以及巴西,疫情依然严重,据统计,连续多日,印度单日新增确诊感染超过30万人。如何预防新冠病毒、积极治疗感染患者,对全球公共卫生依然是重大挑战。
当前对新冠病毒的结构已经了解,对病毒传染机制也有了了解,基于病毒结构和传染机制,全球都在积极开展药物研发。本文对国外文献进行进行编译,介绍下病毒结构、感染机制以及药物靶点等。
Subramanian Boopathi等撰文介绍了新冠病毒结构,与其他冠状病毒结构类似,新冠病毒也主要包括2部分:外层包膜和内层核衣壳。
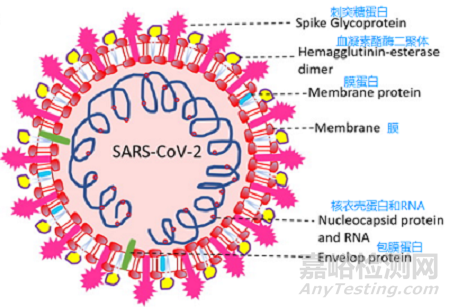
图:新冠病毒结构示意图
来源:J Biomol Struct Dyn. 2020 Apr 30;1-10.
doi: 10.1080/07391102.2020.1758788
Carmen Gil等撰文总结了新冠病毒感染过程,第一步:病毒刺突糖蛋白(S蛋白)与宿主血管紧张素转化酶2(ACE2)受体的结合;第二步,宿主跨膜丝氨酸蛋白酶2(TMPRSS2)对病毒刺突糖蛋白的切割融合;第三步,病毒融合进宿主细胞膜。
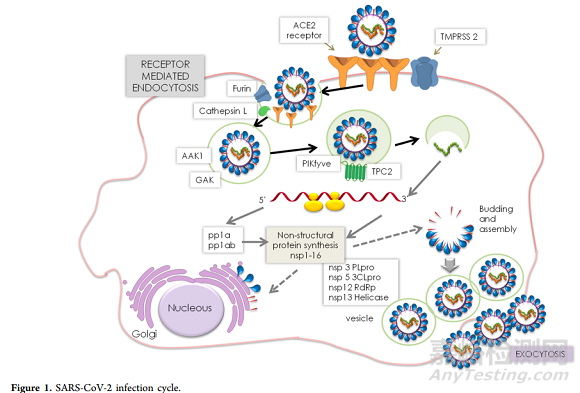
图:新冠病毒感染途径
来源:J. Med. Chem. 2020, 63, 12359−12386.
除了与质膜直接融合之外,Wang及其同事根据对SARS-CoV的观察,将胞吞途径确立为另一种进入宿主途径。Ou, X等研究表明胞吞途径是SARS-CoV-2进入宿主细胞的首选途径。
S蛋白的蛋白酶激活对于冠状病毒的进入宿主细胞至关重要。溶酶体组织蛋白酶对于SARS和MERS-CoV通过胞吞途径进入宿主是必需的。 一旦病毒进入宿主细胞,它就会被分解以释放核衣壳和病毒基因组。
原则上,在寻找SARS-CoV-2的治疗方案时,与病毒复制和宿主细胞控制有关的所有病毒酶和蛋白质都是潜在的成药靶点。
基于病毒的靶点
结构蛋白质Structural Proteins.
刺突糖蛋白spike (S) glycoprotein、包膜蛋白envelope (E) protein、膜蛋白membrane (M) protein和核衣壳蛋白nucleocapsid (N) protein。
刺突糖蛋白(S蛋白)在病毒的发病机理和器官嗜性中起重要作用,通过受体识别和膜融合作用引起病毒感染;包膜蛋白(E蛋白)是结构蛋白中最小的,但在病毒的组装、出芽、包膜形成和致病性方面起关键作用 ;膜蛋白(M蛋白)的主要功能是由于其膜弯曲特性而促进病毒装配;核衣壳蛋白(N蛋白)是组装病毒RNA基因组的多功能蛋白。
非结构蛋白质Non-structural Proteins (nsps).
与其他冠状病毒一样,SARS-CoV-2具有16中高度保守的非结构蛋白质,并表现出不同的功能,包括上述4种蛋白的形成。
瑞德西韦的可能靶点就是非结构蛋白质(nsps)中RNA依赖性RNA聚合酶(RdRp)。
基于宿主的靶点
血管紧张素 | 转换酶2(ACE2)受体
Angiotensin I Converting Enzyme 2 (ACE2) Receptor
冠状病毒的感染主要是由于病毒与宿主细胞表面的不同受体结合而产生的。在SARS-CoV-2中,最近已确认ACE2是主要的病毒受体。因此,抑制或调节ACE2代表了基于宿主的SARS-CoV-2治疗策略之一。
跨膜丝氨酸蛋白酶2(TMPRSS2)
Transmembrane Serine Protease 2 (TMPRSS2)
不同的宿主蛋白酶可以激活病毒,便于病毒与宿主细胞膜融合。宿主细胞表面跨膜丝氨酸蛋白酶2(TMPRSS2)激活高致病性人冠状病毒SARS-CoV和MERS-CoV的S蛋白。TMPRSS2在人体的胃肠道,泌尿生殖道和呼吸道上皮中高表达。其他蛋白酶(例如内体组织蛋白酶)相比,TMPRSS2切割S蛋白更适合于冠状病毒感染。
弗林/Furin
研究发现,SARS-CoV-2的S蛋白中有一个“弗林蛋白酶样切割位点”(FCS),可以解释该病毒的高致病性。
组织蛋白酶L/Cathepsin L
通过裂解蛋白酶激活SARS-CoV-2的S蛋白是病毒感染的关键步骤。不同的溶酶体组织蛋白酶与通过胞吞作用进入人类冠状病毒有关。有研究表明仅组织蛋白酶L参与了SARS-CoV-2内吞作用。
衔接蛋白相关激酶1(AAK1)和细胞周期蛋白G相关激酶(GAK)
Adaptor-Associated Kinase 1 (AAK1) and Cyclin G-Associated Kinase (GAK)
SARS-CoVs的主要进入途径是受体介导的胞吞作用。AAK1和GAK是宿主丝氨酸-苏氨酸蛋白激酶,可调节多种无关RNA病毒(例如狂犬病,埃博拉病毒,登革热或丙型肝炎病毒)的进入,组装和释放过程中的细胞内病毒运输。
磷酸肌醇3-磷酸5-激酶(PIKfyve)
Phosphatidylinositol 3-Phosphate 5-Kinase(PIKfyve)
在胞吞作用中,调节内体成熟动态过程的分子之一是磷脂酰肌醇-3,5-双磷酸酯(PI(3,5)P2)。这种磷脂是由PIKfyve在核内体晚期合成的,PIKfyve是一种具有脂类和蛋白激酶活性的酶。PIKfyve在胞吞途径相关的几个转运过程起着关键作用。
双孔通道(TPC2)/Two-Pore Channel (TPC2)
在溶酶体系统的不同通道之间,双孔通道(TPC1-3)调节跨细胞膜的钠离子和钙离子的电导。它们是电位-门控通道,TPC2由PI(3,5)P2这种磷酸肌醇激活。这些参与溶酶体运输和埃博拉进入宿主细胞的调节。
基于上述靶点可以开展各种抗病毒药物的开发。期待有特效药被开发出来
参考资料
--Subramanian Boopathi, Adolfo B Poma, Ponmalai Kolandaivel, Novel 2019 coronavirus structure, mechanism of action, antiviral drug promises and rule out against its treatment. J Biomol Struct Dyn. 2020 Apr 30;1-10. doi: 10.1080/07391102.2020.1758788.
--Carmen Gil, Tiziana Ginex, Ines Maestro, etc. COVID-19: Drug Targets and Potential Treatments. J. Med. Chem. 2020, 63, 12359−12386.
--Wang, H.; Yang, P.; Liu, K.; Guo, F.; Zhang, Y.; Zhang, G.; Jiang, C. SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway. Cell Res. 2008, 18 (2), 290−301.
--Ou, X.; Liu, Y.; Lei, X.; Li, P.; Mi, D.; Ren, L.; Guo, L.; Guo, R.; Chen, T.; Hu, J.; Xiang, Z.; Mu, Z.; Chen, X.; Chen, J.; Hu, K.; Jin, Q.; Wang, J.; Qian, Z. Characterization of spike glycoprotein of SARSCoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat. Commun. 2020, 11 (1), 1620.
--其他参考文献

来源:靶点社


