您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-18 11:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.罗氏「艾地骨化醇软胶囊」在华获批上市。罗氏旗下日本中外制药株式会社开发的艾地骨化醇软胶囊(eldecalcitol,ED-71)在中国获批上市。这是一款用于治疗骨质疏松症的活性维生素D3衍生物,最早于2011年在日本上市。在一项中国Ⅲ期关键性临床中,与阿法骨化醇组相比,艾地骨化醇治疗组患者后腰椎骨密度显示出统计学意义的增加。安全性方面与已知研究一致。
2.正大天晴奥美沙坦酯氨氯地平片首仿获批。正大天晴4类仿制药天舒平®(奥美沙坦酯氨氯地平片)获国家药监局批准上市,并视同通过仿制药一致性评价。奥美沙坦适用于治疗原发性高血压,尤其适用于中重度高血压以及单药治疗未达目标患者。原研产品由第一三共制药开发,已于2018年7月获批在中国上市。正大天晴为该品种国内首家获批的仿制药。
3.圣诺生物依替巴肽注射液首家通过一致性评价。圣诺生物4类仿制药依替巴肽注射液(CYHS1700193)获国家药监局批准上市,并视同通过一致性评价,为国内首家。依替巴肽是一款血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂,临床上用于治疗急性冠状动脉综合症(不稳定型心绞痛/非ST段抬高性心肌梗死)。米内网数据显示,该产品在2019年中国公立医疗机构终端增速超过200%,目前由豪森主导市场。
4.恒瑞PD-1两个一线治疗适应症达Ⅲ期临床终点。恒瑞医药PD-1注射用卡瑞利珠单抗(艾瑞卡)在两项Ⅲ期临床中(ESCORT-1st和SHR-1210-III-307)分别达到主要研究终点。ESCORT-1st结果显示,与紫杉醇联合顺铂标准治疗相比,卡瑞利珠单抗联合紫杉醇和顺铂一线治疗晚期食管癌可显著延长患者的无进展生存期和总生存期。SHR-1210-III-307结果显示,卡瑞利珠单抗联合化疗用于晚期或转移性鳞状非小细胞肺癌患者一线治疗,可显著延长患者的无进展生存期。该公司计划向CDE递交上市前的沟通交流申请。
5.泽璟制药JAK抑制剂获FDA孤儿药资格。泽璟制药创新型化学药物盐酸杰克替尼片获FDA授予孤儿药资格,用于治疗骨髓纤维化,包括原发性骨髓纤维化、真性红细胞增多症或原发性血小板增多症继发的骨髓纤维化。盐酸杰克替尼片是一种选择性激酶抑制剂,目前正在中国开展十余项临床研究,其中,用于中重度斑块状银屑病、活动性强直性脊柱炎和骨髓纤维化临床适应症已进入Ⅱ期开发阶段。
6.华润三九与Oncoceutics达成独家授权合作。华润三九宣布获得Oncoceutics公司开发的一款临床期抗肿瘤药物ONC201在大中华区的独家开发、生产及商业化权益。ONC201是一款口服活性小分子DRD2拮抗剂和ClpP激动剂,FDA已授予ONC201用于治疗成人复发性H3 K27M突变高级别胶质瘤的快速通道资质,用于治疗胶质母细胞瘤和H3 K27M突变胶质瘤的孤儿药资质,以及用于治疗H3 K27M突变胶质瘤的罕见儿科疾病认定。根据协议,Oncoceutics将获首付款、里程碑款及销售提成。
国际药讯
1.重磅心衰药诺欣妥即将获FDA扩展适用范围。FDA心血管和肾脏药物咨询委员会(CRDAC)推荐批准诺华Entresto(沙库巴曲/缬沙坦,诺欣妥)扩展适用范围,用于治疗射血分数保留性心力衰竭(HFpEF)患者。Entresto此前已在全球115个国家获批用于治疗射血分数降低性心力衰竭(HFrEF),如果获批,Entresto将成为首个获批治疗HFpEF患者的疗法,以及首个获批用于治疗两种主要慢性心力衰竭类型的药物。
2.AB Science马赛替尼治疗阿尔茨海默病结果积极。AB Science口服酪氨酸激酶抑制剂马赛替尼(masitinib)在治疗轻中度阿尔茨海默病的Ⅱb/Ⅲ期临床中达主要终点。与胆碱酯酶抑制剂和/或memantine+安慰剂方案相比,马赛替尼+胆碱酯酶抑制剂和/或memantine方案使患者ADAS-Cog评分(一种测量对认知和记忆影响的工具)与基线相比的变化得到显著改善;评估患者自我护理和日常生活活动的ADCS-ADL评分也出现显著变化;疾病进展为严重失智状态(MMSE<10)的患者数目显著减少。AB Science计划在未来的医学会议上分享该研究结果。
3.诺华补体疗法iptacopan获FDA突破性疗法认定。诺华制药“first-in-class”口服补体抑制剂iptacopan(LNP023)获FDA授予突破性疗法认定,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。Iptacopan同时也获得用于治疗C3肾小球病的罕见儿科疾病认定。今年10月,iptacopan已在治疗C3肾小球病的Ⅱ期临床中显著降低患者的蛋白尿水平,取得积极中期结果。诺华计划12月启动iptacopan治疗PNH的Ⅲ期临床;明年上半年启动其他疾病的Ⅲ期临床;2023年递交iptacopan的上市申请。
4.IO Biotech免疫调节疫苗获FDA突破性疗法认定。FDA授予IO Biotech公司免疫调节疫苗IO102(IDO靶向)和IO103(PD-L1靶向)突破性疗法认定,与抗PD-1单克隆抗体联用,治疗不可切除/转移性黑色素瘤患者。在一项Ⅰ/Ⅱ期临床中,30例转移性黑色素瘤患者接受了IO102、IO103和抗PD-1抗体治疗。在ESMO2020会议上公布的结果显示,这一组合达到了79%的总缓解率,45%的患者获得了完全缓解。
5.再生元血液肿瘤药物odronextamab多项试验遭FDA叫停。FDA日前暂停了再生元CD20/CD3双抗odronextamab(REGN1979)的多项临床,包括B细胞非霍奇金淋巴瘤(B-NHL)的Ⅰ期单药治疗试验、慢性淋巴细胞白血病的中期检查以及针对几种B-NHL亚型的单药治疗测试。FDA要求再生元进一步降低3级细胞因子释放综合征的发生率,并按要求重新修改协议。据悉,由于药物作用机制的原因,几乎所有的CD3药物都存在细胞因子释放综合征的问题。
医药热点
股市资讯
【恩华药业】公司产品咪达唑仑注射液首家通过一致性评价,用于镇静、抗焦虑、记忆缺失。
【人福医药】(1)全资子公司“Epic Pharma”产品盐酸多西环素片获得美国FDA批准文号,用于治疗立克次体病,支原体属感染,衣原体属感染,回归热,布鲁菌病等症状。(2)子公司“人福利康”产品琥珀酸索利那新片获得药品注册批件,用于膀胱过度活动症患者伴有的尿失禁和/或尿频、尿急症状的治疗。
【海思科】全资子公司“辽宁海思科”产品环泊酚注射液获得《药品注册证书》,用于消化道内镜检查中的镇静。
审评动向
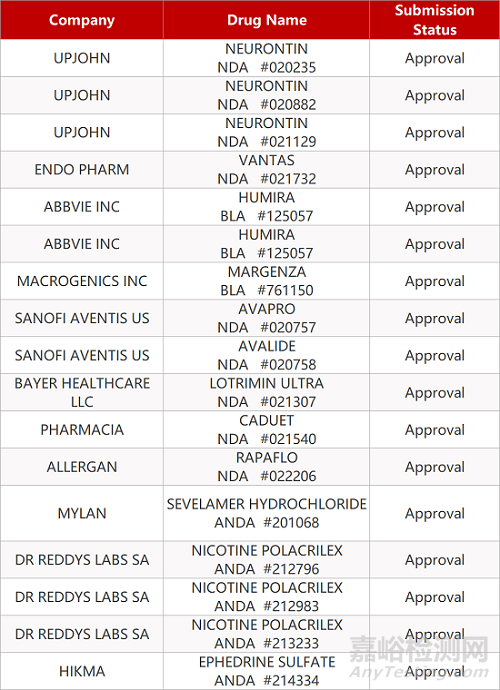
2. FDA最新获批情况(北美12月16日)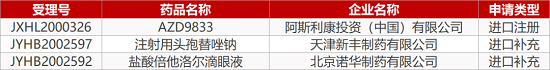
- The End -

来源:药研发


