您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-12-06 17:55
本文主要介绍有源医疗器械产品技术要求附录A的内容。
国家药品监督管理局在2008年发布了关于执行 GB 9706.1-2007《医用电气设备 第一部分:安全通用要求》有关事项的通知(国食药监械[2008]314号),该通知说明有源医疗器械技术要求附录A中需要注明产品主要安全特征,并概括了这些主要的安全特征内容为十一条,如下图:

那么这些内容是什么意思?又该如何理解呢?我们一起来看下~
一、按防电击类型分类
在这行就是要列明产品的防电击类型
GB9706.1-2007安规检测项目详解(一)
在我上面的这篇文章中也有讲过,在此再重新看一下:
GB9706.1-2007第5.1条:按照防电击的类型分类可以分为I类设备、II类设备、内部电源设备。先看定义
I类设备:对电击的防护不仅依靠基本绝缘,而且还有附加安全保护措施,把设备与供电装置中固定布线的保护接地导线连接起来,使可触及的金属部件即使在基本绝缘失效时也不会带电的设备。
I类设备具备保护接地,通俗的讲,电源线为三个插脚(含地线)的为I类设备,电源线为两个插脚(不含地线)的为II类设备
II类设备:对电击的防护不仅依靠基本绝缘,而且还有如双重绝缘或加强绝缘那样的附加安全保护措施,但没有保护接地措施,也不依赖于安装条件的设备。
内部电源设备:电源置于设备内部,提供设备工作所需电能的设备。我们安装电池不连接供电网的都属于内部电源设备。
其实还有另外一类,那就是具有网电源连接装置的内部电源设备,这类设备需要双重分类,举个例子,在正常工作时使用内部电源供电,但设备上留有充电插口,在充电模式下需要链接网电源,那么这类设备就是内部电源设备+I类设备或者内部电源设备+II类设备。
注意:使用功能接地的II类设备也可能电源线为3个插头,但这种情况比较少见。
二、按防电击的程度分类
这行就是要列明产品的防电击程度
同样的GB9706.1-2007第5.2条:按防电击的程度可以分为B型应用部分、BF型应用部分和CF型应用部分,关于这部分的判定是厂家来声称,然后检测所根据厂家的声称来检测是否符合,比如我声称CF型,检测所检测后发现只能满足BF型要求那么就是不合格,如果改声称为BF型,那么这项就合格。当然也不能盲目声称,在声称何种类型前一定要先进行相应的测试来验证下。
具体什么是B型,什么是BF型,什么是CF型呢?一起来看下
如果没有应用部分那就既不属于B型也不属于BF、CF型,归到无分类-无应用部分。
如果有应用部分那么要么就是B型,要么就是BF型,要么就是CF型,只有这三种情况。
重要知识:
B 型:对电击有特定防护程度的设备,符合本标准要求,尤其是漏电流容许值要求,也就是只要带应用部分最低就要是B型。
BF型:有F型应用部分的B型设备,那么什么是F型应用部分呢?标准上是这么说的,与设备其他部分相隔离的应用部分,其绝缘达到,当来自外部的非预期电压与患者相连,并因此施加于应用部分与地之间时,流过其间的电流不超过单一故障状态时患者漏电流的容许值。
F型隔离是对应用部分而言的,也就是应用部分不仅与带电部件隔离绝缘,而且与地也应该隔离绝缘。F型应用部分不是BF型就是CF型。BF型应用部分对电击的防护能力和漏电流容许值均不低于B型应用部分,而且应用部分应该与其他带电电路和大地进行F型浮动隔离。
那如何判断B型和BF型呢?当然就是要判断产品是否有F型应用部分,另外一个简单的方法就是在应用部分施加一个242V电压,如果漏电流满足要求便可以声称为BF型。
CF型:直接用于心脏的设备或设备部件必须为CF型。CF型和BF型在结构上一致,但CF可以直接应用于心脏部位,BF型却不能,CF型的患者漏电流容许值为BF型的1/10。
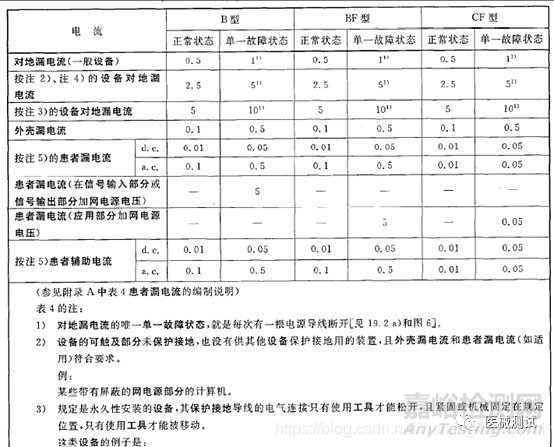
虽然这个类型是厂家自己声称的,但是如果你没有F型应用部分你就只能声称为B型,如果你有F型应用部分那么你就必须声称为CF型或者BF型,当然声称前其实应该进行一个预测试的,如果满足CF型的漏电流容许值要求,那么你可以声称BF型也可以声称CF型;如果你有F型应用部分但你BF型的漏电流容许值要求都满足不了,显然这是一个不合格产品,需要整改。如果是用于心脏的设备或附件就必须是CF型的。你明白了吗?
三、按对进液的防护程度分类
按GB4208中规定对进液的防护程度进行分类,不防水的话可以写为IPX0,这个也比较常见了,用字母IP后接上X然后按照GB4208外壳对有害进液防护程度来区分(1-9)
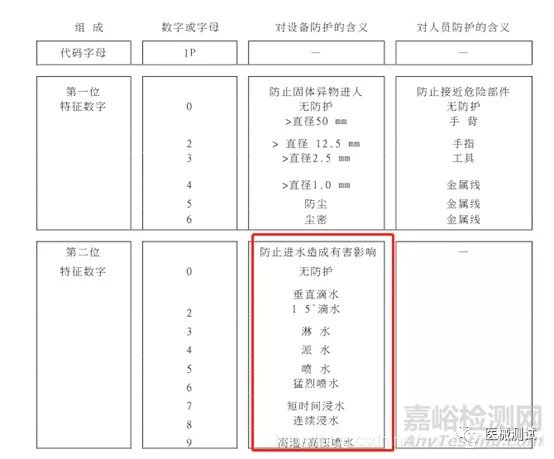
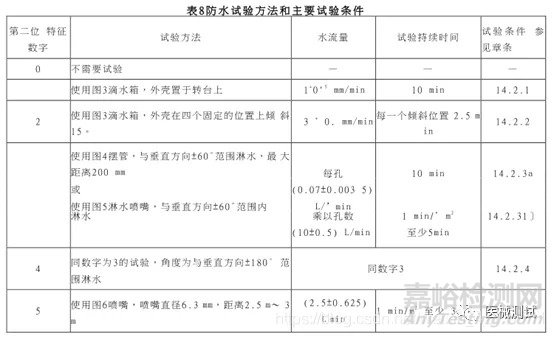
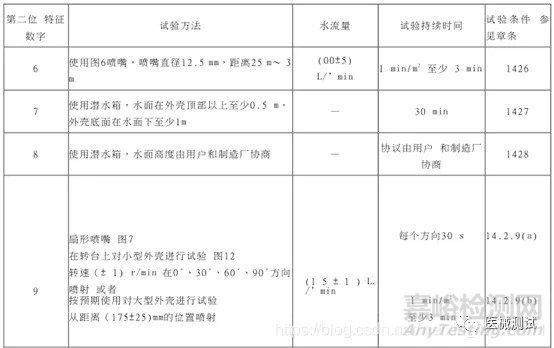
这个也是制造商自己根据实际设计情况进行声称的,当然也要预先试验,每个等级都有相对应的试验方法,见下图
四、按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气情况下使用时的安全程度分类
关于AP型和APG型定义也可以结合标准查看,这种设备比较少见,如果不是AP型也不是APG型那么便是非AP/APG型,这类也最常见,因此可写为非AP/APG型。
五、按运行模式分类
按照GB 9706.1-2007进行注册的设备,按运行模式分类可以分为:连续运行、短时运行、间歇运行、短时加载连续运行和间歇加载连续运行等五类,若无特殊说明那么默认为连续运行。
下面结合一图来让大家能更清晰直观的了解一下这几个类型
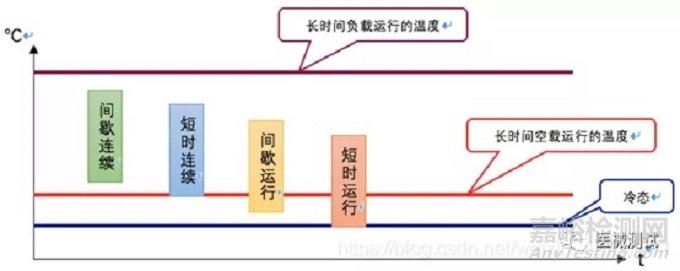
这里面的间歇连续即为间歇加载连续运行,短时连续即为短时加载连续运行。
连续运行:额定负载下不超过规定温度限值。
短时运行:从冷态启动,在规定周期内和额定负载条件下,工作温度不超过规定值的运行,各运行周期的间歇时间相当长,足以使设备冷却到冷态。
间歇运行:由一系列规定的相同周期组成的运行状态,每一周期均包括一个温度极限不超过规定值的额定负载运行期和随后的设备空转或切断的间歇期。
短时加载连续运行:设备一直和电网相连接运行,规定的容许加载时间很短,以至不会达到长时间负载运行的温度,而随后的间歇时间足够长,使设备冷却到长时间空载运行的温度。
间歇加载连续运行:设备一直和电网相连接运行,规定的容许和加载时间很短,以致不会达到长时间负载运行的温度;而随后的间歇时间又不够长到使设备冷却到长时间空载运行的温度。
而如果按照GB 9706.1-2020进行注册的设备,那么运行方式就比较简单了,只有2种:连续运行或者非连续运行。
六、设备的额定电压和频率
这个就简单了,照着设备铭牌上的电压和频率信息直接抄,可以写电压范围,如:AC220V 50Hz,当然如果是直流或者内部电源设备就没有频率值,如DC6V 无频率参数。
七、设备的输入功率
按产品铭牌上的功率信息填写,额定输入必须以安培或伏安表示,当功率因数大于0.9时也可用瓦表示。
八、设备是否具有对除颤放电效应防护的应用部分
如果应用部分有防除颤功能那么需要注明,否则直接写:无。
九、设备是否具有信号输出或输入部分
按产品的实际情况编写,如果有信号输入/输出口时,注明“有”,如果没有信号输入/输出口时,注明“无”。常见的信号输入/输出口如USB口、RS232口、网络LAN口等。
十、永久性安装设备或非永久性安装设备
按与电源的连接情况写明。最简单的判别方式也是可以通过插头的使用情况进行判断,如果不使用插头,设备的电源线直接与墙上电路系统连接,拆除需要使用工具时,注明“永久性安装设备”,如果使用插头,则为非永久性安装设备。
十一、电气绝缘图
电气绝缘图标明产品设计的绝缘路径,需要注意的是,附录A不仅仅要有电气绝缘图,还需要同时附上绝缘表格,该表格包含绝缘路径、绝缘类型、基准电压、试验电压、爬电距离、电气间隙等内容。
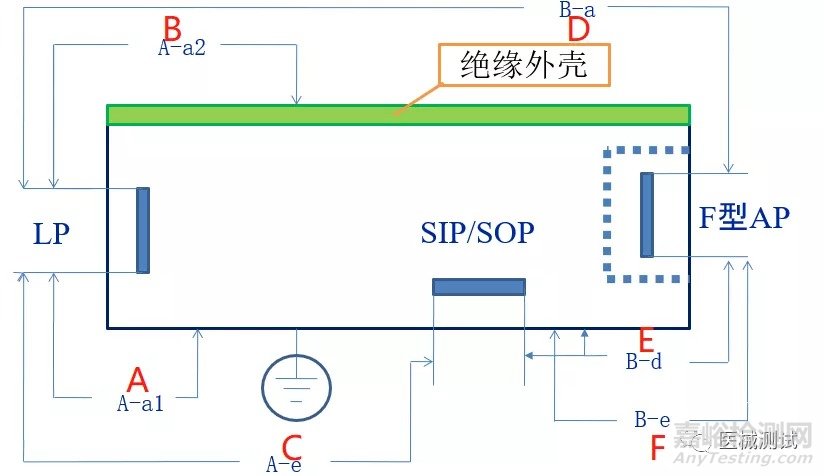
以上图为例介绍一下
绝缘表格如下:
| 位置 | 绝缘路径 | 绝缘类型 | 基准电压(V) | 试验电压(V) | 爬电距离(mm) | 电气间隙(mm) |
| A | A-a1 | BI | ac 220 | ac 1500 | 4 | 2.5 |
| B | A-a2 | DI/RI | ac 220 | ac 4000 | 8 | 5 |
| C | A-e | DI/RI | ac 220 | ac 4000 | 8 | 5 |
| D | B-a | DI/RI | ac 220 | ac 4000 | 8 | 5 |
| E | B-d | BI | ac 220 | ac 1500 | 4 | 2.5 |
| F | B-e | DI/RI | ac 6 | ac 500 | 3.4 | 1.6 |
我们假设带电部分LP为网电源电压ac220V,应用部分自身电压ac6V,位置A-F如上图,对应的绝缘路径也已经标明,或者大家可以查看GB9706.1-2007第20章:电介质强度:
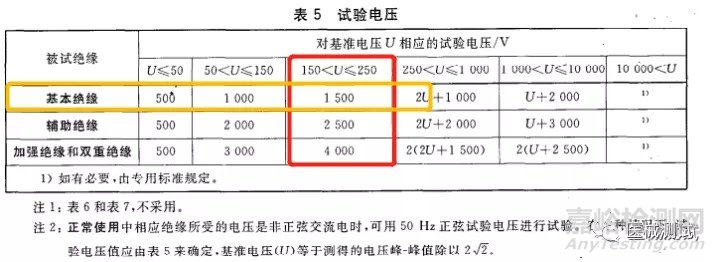
来看表第一行:位置A对应绝缘路径为A-a1,绝缘类型的话就是基本绝缘,基准电压为ac220V,这可以结合第20章第3节来判定,试验电压参考表5来判断,150<U≤250,然后再看绝缘类型为基本绝缘我们得出试验电压为1500,如下图红色框和黄色框交叉部分,其他几个也是依据此方法进行判断。
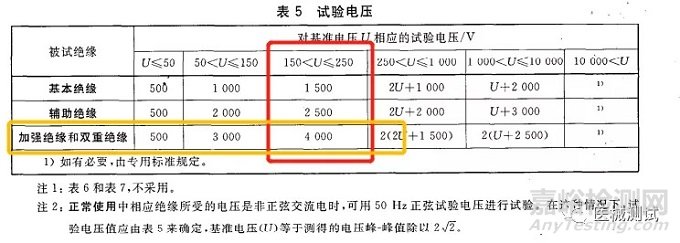
再看:位置B对应绝缘路径为A-a2,绝缘类型的话就是双重绝缘或者加强绝缘,基准电压为ac220V,试验电压参考表5来判断,150<U≤250,然后再看绝缘类型为DI/RI,我们得出试验电压为4000,如下图红色框和黄色框交叉部分
其他几个各位可以自行尝试练习~
这个试验电压也就是我们进行电介质强度测试时的电压值,爬电距离和电气间隙的话查表16,注意爬电距离和电气间隙的判断与基准电压有关,要依据基准电压来进行判断,如果基准电压值在表16所规定的两个数值之间,应采取两者中的较高值。比如位置A,基准电压为ac220V,基本绝缘,那么爬电距离就是4.0mm,电气间隙为2.5mm。如下图红框和黄框交叉处
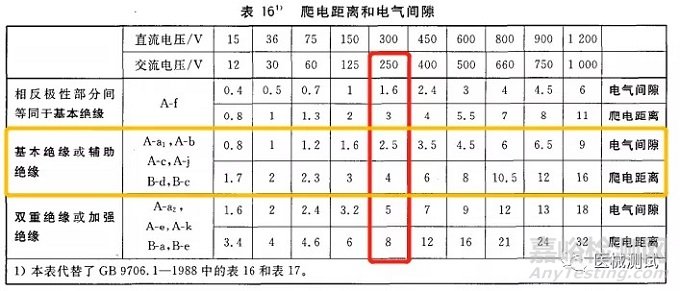
再看:位置B,基准电压为ac220V,双重绝缘或者加强绝缘,那么爬电距离就是8.0mm,电气间隙为5.0mm
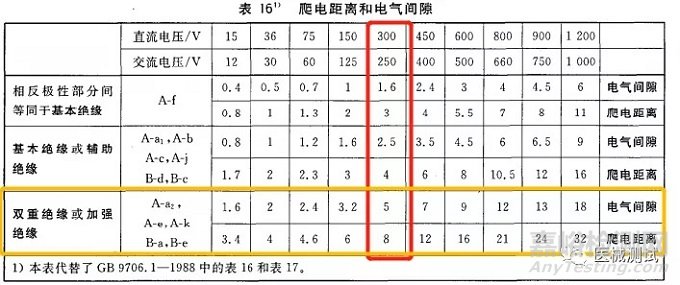
其他几个判断方法一样,大家也可以自行进行练习判断。

来源:医械测试


