您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-19 19:05
“日前,波士顿科学(Boston Scientific)的Ranger药物洗脱球囊(DCB)获得美国FDA的批准,用于治疗下肢动脉缺血的患者。”
下肢动脉缺血的主要原因是动脉粥样硬化,常表现为间歇性跛行、静息痛、肢端溃疡、坏死等,严重影响患者生活质量,可导致截肢甚至危及生命。
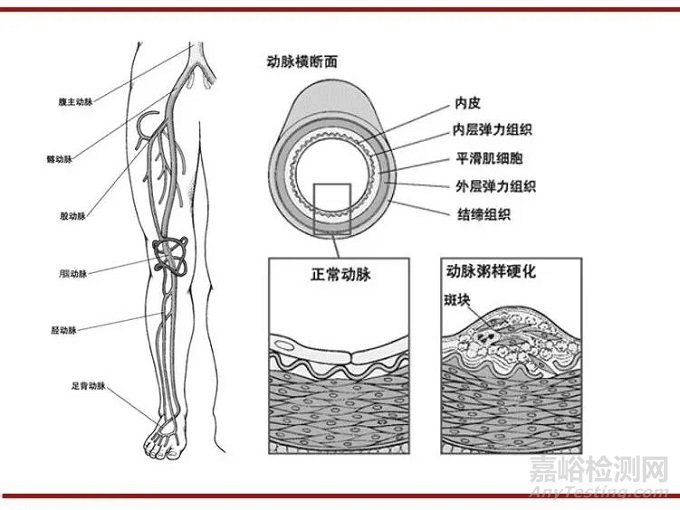
(图:下肢动脉(左)、动脉粥样硬化(右))
(资料来源:《默克家庭诊疗手册》 思宇医械观察整理)
普通球囊血管成形术目前已广泛应用于治疗下肢动脉缺血性疾病,虽然具有较好的疗效,但扩张后再狭窄的发生率较高,术后6~12月内再狭窄的发生率为40%~60%,再狭窄多发生在术后数月至1年之内。主要原因是球囊扩张部位内膜纤维细胞增生。球囊扩张成形术是一种损伤血管壁的机械治疗方法,术后必然会引起一系列修复反应,这就成为再狭窄的病理学基础。因此,抗术后再狭窄成为普通球囊血管成形术需要在今后解决的关键问题。
紫杉醇用于抗血管壁的再狭窄已经超过10年。细胞学和动物实验结果表明,紫杉醇具有明显的抗增殖活性。紫杉醇本身具有疏水性、浓聚于动脉内膜的能力、对细胞抑制作用持久等特性,这些特性都有利于局部释放后作用于动脉内膜减少再狭窄的发生。
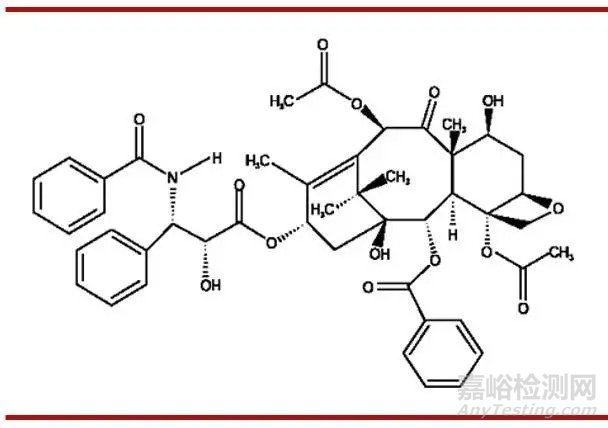
(图:紫杉醇结构图)
(资料来源:科研文献 思宇医械观察整理)
2006年,第一个紫杉醇药物洗脱球囊(DEB)治疗冠状动脉支架内再狭窄的临床研究预试验结果证明DEB与非药物洗脱球囊相比同样安全,但更加有效。随后药物洗脱球囊扩张导管的研发进入快车道,其适应证也从冠状动脉扩张至外周血管。
2020年10月30日,波士顿科学Ranger™ 紫杉醇药物洗脱球囊获得FDA批准(P190019B)。该药物洗脱球囊适用于股浅动脉和近端腘动脉(SFA/PPA)经皮腔内血管成形术(PTA)治疗原发性或非支架导致的继发性狭窄,其治疗长度最长达180mm,参考血管直径为4~7mm。
Ranger™ 紫杉醇药物洗脱球囊是一次性使用的无菌同轴整体交换型(Over the Wire, OTW)药物涂层球囊,其药物涂层是由紫杉醇和赋形剂乙酰柠檬酸三丁酯(ATBC)组成,紫杉醇在球囊表面标称药物剂量密度为2µg/mm2。球囊通过机械作用打开阻塞的血管,与此同时球囊表面含有赋形剂的紫杉醇释放至受损的血管内皮,通过减少治疗部位的再狭窄以延长血管再通率。
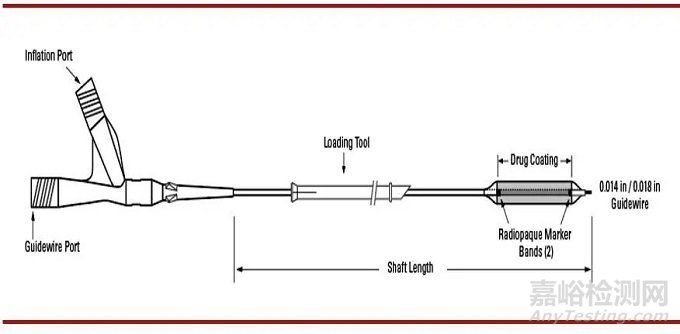
(图:Ranger™紫杉醇药物洗脱球囊)
(资料来源:FDA官网 思宇医械观察整理)
球囊长度为30~100mm的Ranger™ 紫杉醇药物洗脱球囊于2014年7月首次获得CE认证;球囊长度为120~200mm的Ranger™ 紫杉醇药物洗脱球囊于2017年7月再次获得CE认证。目前该球囊已经在69个国家或地区进行销售。
此次Ranger™ 紫杉醇药物洗脱球囊的FDA注册申报资料是基于Ranger II SFA临床试验的12个月安全性和有效性数据。该临床试验为前瞻性、国际多中心、3:1随机分组、裸球囊对照、单盲、第三方盲评、主要安全性指标非劣检验、主要有效性指标优效检验,于2017年3月2日在美国、加拿大、奥地利、比利时、日本和新西兰的67家研究机构开展,计划入组376名原发性或非支架导致的继发性狭窄患者,其中试验组278例,对照组98例。所有患者于术后第1、6、12、24、36、48和60个月进行临床评估。拟收集的主要安全性评价指标是主要不良事件(MAEs)发生率,定义为术后1个月内的全因死亡以及术后12个月内的靶病变截肢或靶血管重建(TLR)。主要有效性评价指标是术后12个月靶病变通畅率,定义为经双功能超声检查,靶病变术后血液峰值收缩速度比(PSVR)≤2.4,且靶病变未出现临床驱动的TLR或血管旁路术。次要指标包括:技术成功率、手术成功率、临床成功率、60个月主要不良事件、TVR\TLR、卢瑟福评分、ABI、再狭窄率、六分钟步行距离(6MWT)、生存质量等。此外,临床试验过程中还有部分受试者进行了药代动力学研究和长病变疗效的亚组分析。
截至2019年11月19日共有343名受试者按照Ranger II SFA方案的要求完成了12个月的临床随访,波士顿科学就此进行第1阶段的数据统计分析,并以此作为FDA注册申报的依据。经ITT分析,试验组12个月主要不良事件未发生率是94.1%,而对照组是83.5%,两者差值的95%置信区间为(2.5%, 18.8%),非劣界值-10%,满足最初的假设检验。试验组12个月通畅率是82.9%,而对照组是66.3%,两者差值的95%置信区间为(5.5%, 27.7%),优效界值0%,满足最初的假设检验。其他次要指标在两组间的差异均无统计学意义。
而在Ranger II SFA试验之前波士顿科学还实施过一个以“晚期管腔丢失(LLL)”为主要评价指标的临床试验。该临床试验为前瞻性、多中心、2:1随机分组、裸球囊对照、单盲、第三方盲评、优效检验,在德国、法国和奥地利的10家研究机构共纳入105名受试者。试验组6个月晚期管腔丢失(-0.16±0.99mm)明显少于对照组(0.76±1.4mm),满足最初的假设检验。12个月通畅率试验组也要优于对照组(86% vs 52%)。12个月卢瑟福评分、ABI、生活质量两组间基本相似。但继续对这些受试者进行36个月随访后发现,试验组有9例、对照组有3例受试者死亡。
鉴于FDA在2019年1月17日、3月15日、6月19日发出紫杉醇药物涂层产品风险警示,“使用紫杉醇药物洗脱球囊和药物洗脱支架治疗下肢动脉疾病患者的晚期死亡率可能增加。”,波士顿科学对该产品可能导致的晚期死亡率增加进行了研究分析。由于Ranger II SFA试验的2年和3年的随访数据有限,为了证明Ranger™ 紫杉醇药物洗脱球囊与目前已上市产品相比,并不会增加额外的不可接受的晚期死亡率风险。基于现有数据采用贝叶斯预测术后2年和3年死亡率,并采用Kaplan-Meier进行分析。最终根据所提供的全部数据,与目前已上市产品的紫杉醇涂层产品相比,Ranger™ 紫杉醇药物洗脱球囊似乎没有出现不可接受的死亡风险。
基于上述临床试验数据以及补充分析,FDA最终批准了该产品的上市,但在其说明书的“警告和预防措施”中增加了:“患者使用紫杉醇涂层球囊和紫杉醇洗脱支架治疗股腘动脉狭窄后,与非药物涂层产品相比,在术后大约2~3年会观察到晚期死亡风险增加的信号。关于晚期死亡风险增加的程度和机制,包括是否来源于其他产品的影响,存在不确定性。医生应该与患者讨论并说明晚期死亡风险增加的可能,以及不同治疗方案的好处和风险。”
目前在中国已经取得注册证的药物涂层外周球囊扩张导管有:
| 公司名称 | 国械注进 |
| 美敦力 | 20203030288 |
| 上海微创心脉 | 20203130445 |
| 北京先瑞达 | 20163031020 |
| 浙江归创 | 20203030857 |
结语
考虑到Ranger II SFA试验入组人群中包括102例日籍人士,而日籍人士与中国人同属黄种人。该临床试验目前比较符合《接受医疗器械境外临床试验数据技术指导原则》的要求,它可能会采用境外临床试验数据申报方式成为下一款上市中国的外周药物洗脱球囊。含有紫杉醇涂层的心血管产品是否会增加患者的死亡风险可能还需要进一步研究,同时可能会成为今后审评关注的重点内容。

来源:思宇医械观察


