您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-30 09:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
新型长效生长激素TransCon hGH在美申请上市。Ascendis公司已向FDA提交了每周一次长效生长激素TransCon hGH用于治疗儿童生长激素缺乏症(GHD)的生物制品许可申请。在一项III期heiGHt研究中,采用协方差分析意向性治疗群体,TransCon hGH治疗组AHV(年化身高速率)为11.2厘米/年,每日hGH组为10.3厘米/年(两组差值:0.86厘米/年,95%CI:0.22-1.50,p=0.0088)。研究中,TransCon hGH总体安全,耐受性良好,不良事件与每日hGH治疗组观察到的类型和频率一致,且试验组之间具有可比性。
国内药讯
1.第三款国产托法替布即将获批。科伦制药4类仿制药枸橼酸托法替布片的上市申请审评状态变更为"在审批",预计即将获批上市,成为继正大天晴和齐鲁制药之后拿到该品种生产批件的国内药企。托法替布(Tofacitinib,Xeljanz)是一款靶向JAK1/JAK3的口服小分子抑制剂,原研产品由辉瑞开发,目前已获批治疗对氨甲喋呤治疗反应不足或不耐受的中重度活动性类风湿性关节炎(RA)、银屑病关节炎和溃疡性结肠炎。该原研药2017年3月已获批进口中国。2018年中国公立医疗机构终端该品种销售额约834万元。
2.康希诺重组新冠疫苗获军队特需药品批件。康希诺生物与军事科学院军事医学研究院生物工程研究所联合开发的重组新冠病毒疫苗Ad5-nCoV(腺病毒载体)于2020年6月25日获得中央军委后勤保障部卫生局颁发的军队特需药品批件,有效期一年。Ad5-nCoV已在6月11日完成II期临床试验揭盲。临床数据证实其具有良好的安全性,及较高的体液免疫及细胞免疫应答水平。总体试验结果表明,Ad5-nCoV具有预防由SARS-CoV-2引起疾病的潜力。
3.奥赛康药业TPO-R激动剂申报上市。奥赛康药业艾曲泊帕乙醇胺片4类仿制药的上市申请获CDE受理。艾曲泊帕乙醇胺片是一种非肽类口服血小板生成素受体(TPO-R)激动剂,目前中国境内仅有原研产品瑞弗兰(艾曲泊帕乙醇胺片,诺华)获批上市,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性原发免疫性血小板减少症(ITP)患者的血小板减少。本次奥赛康药业提交上市申请意味着中国有望迎来该品种的首个仿制药。
4.三生国健抗IL-4Ra单抗在美国获批临床。三生国健自主研发的抗IL-4Ra人源化单克隆抗体(研发代号:611)获FDA临床试验批准,用于治疗特应性皮炎(湿疹)患者。IL-4Ra是白介素4(IL-4)及白介素13(IL-13)的信号传导复合体的一部分,在特应性皮炎的发病机制中起关键性作用。611能够通过抑制IL-4Ra,阻断IL-4和IL-13的信号传导达到缓解特应性皮炎等疾病的作用。目前该产品在国内的临床试验申请也获得NMPA受理。
5.诺华创新RNAi降胆固醇药物在华申报临床。诺华在中国提交的Inclisiran注射液临床申请获得CDE受理。该药是诺华收购The Medicines Company获得的一款小分子干扰RNA(siRNA)降胆固醇药物。发表于NEJM的3项III期临床(ORION-9、10和11)结果表明,与安慰剂相比,在接受两次初始剂量注射后,每年两次皮下注射inclisiran治疗能持久和显著地降低LDL-C;而且inclisiran具有良好的耐受性,安全性与安慰剂相似。诺华已向FDA和EMA提交了Inclisiran上市申请。
6.索元生物完成C轮融资。索元生物完成人民币5.9亿元的C轮融资。本轮融资由中金启德创新生物医药股权投资基金领投。索元生物是一家新型的、以快速有效的独特模式开发一类新药的国际化企业,目前拥有肿瘤和精神类疾病领域已开发至临床后期的六个产品(DB102 - DB107 )的全球权益,均为全球首创药物(First in Class)。其中DB102(enzastaurin)最初由礼来开发,索元生物利用其生物标记物平台技术发现一组全新的生物标记物DGM1,DGM1阳性患者在服用DB102后其生存期有着非常显著的改善。目前评估DB102用于CD20阳性的弥漫性大B细胞淋巴瘤(DLBCL)的III期ENGINE研究正在中美两国开展。
国际药讯
1.FDA批准首个治疗肢端肥大症的口服疗法。Chiasma公司开发的口服生长抑素类似物MYCAPSSA®(octreotide,奥曲肽)胶囊获FDA批准上市,用于使用奥曲肽或兰瑞肽(lanreotide)出现治疗反应和耐受性的肢端肥大症患者的长期治疗。MYCAPSSA是该公司首个获批商业化的产品,也是FDA批准该适应症的的首个口服疗法。在一项Ⅲ期临床CHIASMA OPTIMAL中,与安慰剂组相比,MYCAPSSA治疗组9个月后维持生化反应(IGF-1水平的平均值≤1.0×ULN)的患者比例显著提高,试验达到主要终点和所有四个次要终点目标。
2.艾尔建nAMD药物abicipar pegol遭FDA拒绝批准。艾尔建收到FDA发出的完整回应函,其新生血管(湿性)年龄相关性黄斑变性(nAMD)药物abicipar pegol的生物制剂许可申请(BLA)遭到该机构的拒绝。此次提交BLA申请是基于CEDAR和SEQUOIA这两项Ⅲ期临床的数据。两项研究在未经治疗的nAMD患者中比较abicipar pegol与基因泰克Lucentis(ranibizumab)的疗效,结果显示,52周时abicipar pegol的疗效非劣效于Lucentis,并且所有治疗组的总体不良事件发生率相似。FDA最终的决定似乎与药物相关的安全问题有关。
3.阿斯利康公布慢阻肺三联疗法Ⅲ期完整结果。阿斯利康三联疗法倍择瑞®令畅®(布地奈德/格隆溴铵/富马酸福莫特罗)治疗中度至极重度慢性阻塞性肺疾病Ⅲ期ETHOS研究发表于《新英格兰医学杂志》上。与格隆溴铵/福莫特罗吸入气雾剂相比,三联疗法使患者的急性加重率降低了24%(p <0.001);使全因死亡风险降低了46%(未校正p = 0.01)。与PT009布地奈德/富马酸福莫特罗相比,三联疗法使患者的急性加重发生率降低了13%(p = 0.003)。倍择瑞®令畅®已在日本和中国获批用于治疗慢阻肺,并正在美国和欧洲接受监管部门审批。
4.Myovant前列腺癌口服创新疗法获优先审评资格。Myovant Sciences公司GnRH受体拮抗剂relugolix用于男性晚期前列腺癌的新药申请获FDA受理,FDA同时授予其优先审评资格,预计今年12月20日之前做出回复。在一项Ⅲ期临床中,relugolix达主要终点,接受relugolix治疗的男性患者中96.7%在48周内睾酮持续抑制水平达到去势水平(<50 ng/dL),而醋酸亮丙瑞林对照组患者中88.8%达到这一水平。此外,relugolix将患者发生主要不良心血管事件的风险降低54%。如果获批,relugolix将成为唯一一个治疗这类患者的口服GnRH受体拮抗剂。
5.CSL Behring与uniQure公司达成研发合作。uniQure公司与CSL Behring达成一项研发许可协议,授予CSL Behring治疗B型血友病的基因疗法etranacogene dezaparvovec的全球独家权利。Etranacogene dezaparvovec由表达凝血因子IX的转基因和AAV5病毒载体组成。在一项ⅡB期临床中,患者中位凝血因子IX活性水平在接受治疗6周后达到正常水平的31%,在36周时达到正常水平的45%;而且研究中患者没有出现出血事件,也不需要接受凝血因子替代疗法。根据协议,uniQure将获4.5亿美元的前期现金付款,可能高达16亿美元的里程碑付款以及产品的销售分成。
医药热点
1.北京公立医疗机构核酸检测价格120元/次。北京市医保局副局长、新闻发言人杜鑫28日在北京市新冠肺炎疫情防控工作新闻发布会上表示,25日起,北京全市公立医疗机构核酸检测价格由每次180元降低至120元,该价格为最高政府指导价,医疗机构不得上浮,但可根据自身情况下浮调整,下浮幅度不限。据介绍,非公立医保定点医疗机构在为参保人员提供核酸检测服务时,也按照上述政策执行。
2.辽宁出台17种医疗违法违规行为举报奖励办法。辽宁省卫健委公布《辽宁省医疗卫生行业违法违规行为举报奖励办法(征求意见稿)》,明确对医疗卫生行业违法违规行为的举报奖励范围,举报奖励标准、监督管理等二十五条细则。其中,对机构或个人医疗卫生行业违法违规行为举报奖励范围共有17项。《办法》明确根据举报人提供的线索与事实相符合的程度、社会危害性及对医疗卫生违法违规行为罚没款金额,对举报人给予一次性奖励,每起案件的奖励金额原则上不超过1万元。
3.外媒统计:每18秒就有1人死于新冠肺炎。美国约翰斯·霍普金斯大学发布的新冠疫情统计数据显示,截至北京时间6月29日4时33分,全球已有超过50万人因感染新冠肺炎而死亡。路透社根据6月1日至27日的平均数据计算,每24小时就有超过4700人死于与新冠病毒相关的疾病,也就是说,每1小时就有196人死亡,或者每18秒就有1人死亡。
股市资讯
审评动向
1. CDE最新受理情况(06月29日)
2. FDA最新获批情况(北美06月26日)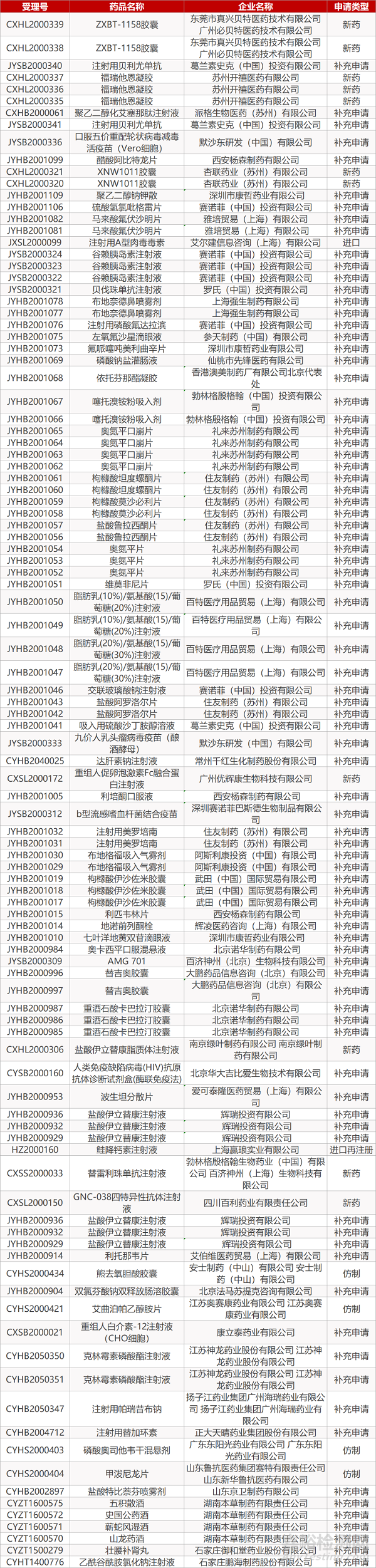
暂无
- The End -

来源:Internet


