您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-06 09:15
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
强生创新皮下制剂治疗多发性骨髓瘤获批上市。强生旗下杨森公司新型daratumumab皮下制剂Darzalex Faspro(daratumumab和重组人透明质酸酶)获FDA批准上市,治疗多发性骨髓瘤患者。Darzalex Faspro可以在大约3到5分钟内给药,与Darzalex相比,将患者的给药时间从几小时缩短到几分钟。Daratumumab已多次获FDA批准扩展治疗多发性骨髓瘤患者的适用范围。在一项Ⅲ期临床COLUMBA中,Darzalex Faspro与静脉注射Darzalex的总缓解率(ORR)相比达到非劣效性标准,分别为41%和37%。其给药相关不良事件也减少近三分之二,分别为13%和34%。
今日头条
国内药讯
1.石药门冬氨酸鸟氨酸注射液获批上市。石药集团发布公告称,其附属公司石药银湖制药开发的门冬氨酸鸟氨酸注射液(10ml:5g)获得国家药监局批准上市,为国内该品种第三家获批的仿制药。门冬氨酸鸟氨酸为肝病用药,适用于因急、慢性肝病(如各型肝炎、肝硬化、脂肪肝、肝炎后综合症)引发的血氨升高及治疗肝性脑病,尤其适用于治疗肝昏迷早期或肝昏迷期的意识模糊状态。
2.恒瑞非布司他片通过一致性评价。恒瑞医药非布司他片获国家药监局核发的《药品补充申请批件》,该产品通过一致性评价。非布司他片是一种非嘌呤类的黄嘌呤氧化酶(XO)选择性抑制剂,其原研药由日本帝人开发,商品名菲布力,可用于痛风患者高尿酸血症的长期治疗。目前国内市场有3家仿制药企业及原研厂家拥有该产品生产批文。2018年中国公立医疗机构终端非布司他片销售额为10.87亿元。
3.君实PD-1鼻咽癌适应症上市申请获受理。君实生物特瑞普利单抗(拓益)新适应症上市申请获NMPA受理,用于治疗既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者,这也是全球首个抗PD-1单抗治疗复发/转移性鼻咽癌的新药上市申请。在一项Ⅱ期临床研究POLARIS-02(NCT02915432)中,由独立评审委员会(IRC)评估的肿瘤客观缓解率(ORR)达到了主要终点,且安全性数据与特瑞普利单抗过往报道相似。
4.基石药业引进产品Avapritinib全球Ⅲ期临床失败。基石药业合作品种胃肠道间质瘤(GIST)治疗新药Avapritinib 全球Ⅲ期临床数据公布。该研究旨在评估Avapritinib与瑞戈非尼三线或四线治疗GIST的疗效和安全性。统计数据显示,Avapritinib组的总体有效率为17%,显著优于瑞戈非尼组(7%);但Avapritinib组患者的无进展生存期(PFS)为4.2个月,瑞戈非尼组为5.6个月,PFS中位数的差异无统计学意义。Avapritinib 是一款由Blueprint 公司开发的选择性KIT/PDGFRA 抑制剂,曾获FDA授予的突破性疗法、快速审评及孤儿药多重资格认定。
5.贝达药业二代Trk抑制剂获批临床。贝达药业1类新药BPI-28592片获国家药监局批准临床。BPI-28592是一种新型强效、高选择性的原肌球蛋白受体激酶(TRK)二代口服小分子抑制剂,可覆盖多种癌种,拟用于携带NTRK基因变异的局部晚期或转移性实体瘤患者的治疗。目前,已有拜耳/Loxo的拉罗替尼和罗氏的恩曲替尼获批上市,国内尚未有TRK抑制剂获批上市。据悉,BPI-28592临床前数据显示安全性很好。
6.和铂医药合作发现新冠病毒中和抗体。和铂医药与荷兰乌得勒支大学、伊拉斯姆斯大学医学中心的科学家共同宣布,基于和铂医药的H2L2全人源抗体转基因小鼠平台,发现了一款能够在细胞培养系统中有效阻断新冠病毒感染细胞的全人源抗体47D11。47D11能够与新冠病毒刺突蛋白受体结合域的一个保守表位结合,在细胞培养试验中,它虽然不会影响RBD与ACE2受体的结合,但是能够有效抑制新冠病毒对VeroE6细胞系的感染,达到IC50的浓度为0.57 µg/ml。研究成果发布在《自然》子刊Nature Communications上。
7.君实与礼来达成新冠病毒中和抗体合作。君实生物和礼来将联合开发防治COVID-19的抗体疗法JS016。JS016是一款由君实生物与中国科学院微生物研究所共同开发的重组全人源单克隆中和抗体,能够特异性结合新冠病毒表面刺突蛋白的受体结合域,并有效阻断病毒与宿主细胞表面ACE2受体的结合。根据协议,礼来将被授予在大中华地区外对JS016开展研发、生产和销售的独占许可。双方计划在今年第二季度向FDA递交IND申请并启动临床研究。
国际药讯
1.赛诺菲四价脑膜炎球菌结合疫苗在美获批。赛诺菲巴斯德四价脑膜炎球菌(A/C/Y/W组)结合疫苗MenQuadfi获FDA批准用于预防2岁及以上人群的侵袭性脑膜炎球菌引起的相关疾病。5项临床汇总结果显示,与已上市的四价脑膜炎球菌疫苗相比,MenQuadfi在诱导免疫应答方面具有非劣效性。针对4类脑膜炎球菌血清群(A/C/W/Y),在先前未接种过疫苗的受试者中,大多数(55.4%– 97.2%)受试者在接种后30天内发生由疫苗诱导的免疫应答;而在此前接种过疫苗的青少年和成人中,92.2%–98.2%的受试者对每个血清群均有免疫应答。
2.瑞德西韦获FDA紧急使用授权。FDA宣布授予吉利德瑞德西韦紧急使用授权,治疗需要接受氧气辅助治疗的COVID-19住院患者。此次授权是基于由美国过敏和传染病研究所(NIAID)赞助的临床试验和吉利德公司的开放标签临床试验结果。在NIAID赞助的全球Ⅲ期临床中,瑞德西韦将患者康复所需时间降低31%。在吉利德公司的开放标签临床试验中,瑞德西韦5天和10天给药方案疗效相似。欧洲药品管理局日前也已启动对瑞德西韦的滚动审评。
3.罗氏新冠血清学检测试剂获FDA紧急使用授权。罗氏Elecsys®Anti-SARS-CoV-2抗体检测试剂获FDA授予紧急使用授权。Elecsys® Anti-SARS-CoV-2是一种体外定性检测人血清和血浆中新冠病毒抗体(包括IgG)的免疫分析方法,用于确定患者是否已曾受到新冠病毒感染,以及患者是否已产生抗新冠病毒的抗体。据悉该检测试剂血清学试验的特异性大于99.8%,敏感性为100%(在核酸检测确认患者感染新冠病毒后14天)。医院和实验室可使用的罗氏cobase分析仪进行测试,大约18分钟内可提供单个测试的测试结果。
4.Soligenix光敏疗法Ⅲ期试验结果积极。Soligenix公司开发的“first-in-class”光动力疗法SGX301,在治疗皮肤T细胞淋巴瘤(CTCL)的关键性Ⅲ期临床FLASH中,使患者获得持续的临床益处。治疗12周后,与安慰剂组相比,SGX301将患者的疾病缓解率提高到40%,与接受治疗6周后相比(16%),将患者的缓解率提高了2.5倍。达到统计学意义上的显著改善。SGX301此前已获FDA授予的孤儿药资格和快速通道资格。
5.BMS低甲基化药物CC-486获FDA优先审评资格。FDA已受理百时美施贵宝(BMS)在研口服低甲基化药物CC-486的新药申请,用于维持治疗急性髓系白血病成人患者,这些患者在接受诱导疗法后进入完全缓解(CR),或完全缓解伴随不完全血细胞计数恢复。他们不适合或不选择接受造血干细胞移植疗法。FDA同时授予其优先审评资格,预计9月3日之前做出回复。在一项Ⅲ期临床中,中位随访41.2个月时,CC-486治疗组患者中位OS为24.7个月,安慰剂组这一数值为14.8个月(p=0.0009,HR 0.69 [95% CI: 0.55, 0.86)。
6.Vir/Alnylam确定一款治疗COVID-19的候选RNAi疗法。Vir Biotechnology和Alnylam公司联合宣布,已筛选出一款靶向新冠病毒基因组的在研RNAi疗法VIR-2703(ALN-COV)。在剂量反应测定中,这款候选疗法达到EC50时的浓度小于100 pM,EC95的浓度小于1 nM。而且,VIR-2703预计能够对目前公共数据库里超过4300个新冠病毒基因组中超过99.9%的基因组产生活性。它同时能够对SARS病毒基因组产生活性。两家公司计划在年底之前展开这款候选RNAi疗法的人体临床试验。
医药热点
1.15000个病毒基因序列均显示新冠病毒非人造。当地时间4日,世卫组织召开新冠肺炎例行发布会,针对美国总统特朗普和美国国务卿蓬佩奥称新冠肺炎病毒来自武汉病毒研究所,世卫组织卫生紧急项目技术主管玛丽亚·范·科霍夫表示,冠状病毒一般在蝙蝠中传播,目前约15000个完整的病毒基因序列都显示新冠肺炎病毒非人造,世卫组织与粮农组织和世界动物卫生组织以及中国各部门合作,以发现新冠肺炎病毒的中间宿主动物,来避免再次从动物传播到人。
2.美国单日新增确诊病例逾2万例。据美国约翰斯·霍普金斯大学数据实时数据显示,截至北京时间5月5日6时30分左右,全球累计确诊新冠肺炎病例3573864例,累计死亡250687例。其中美国累计确诊1177784例,死亡68442例。与前一日6时30分数据相比,美国新增确诊病例23163例,新增死亡病例991例。据《纽约时报》统计,在全美疫情最严重的纽约州,累计确诊324357例,累计死亡24788例。
3.跨省异地就医人次回升。国家医保局对外发布信息称,随着疫情防控取得阶段性成果和各地复工复产,全国跨省异地就医3月直接结算人次比2月有所回升。截至2020年3月底,全国跨省异地就医定点医疗机构数量为28759家,环比增加437家,其中二级及以下定点医疗机构25898家;国家平台备案人数602万,累计结算467万人次。3月跨省异地就医直接结算13万人次,环比增加91.2%;医疗费用30.3亿元,环比增加71.1%;基金支付18.3亿元,环比增加67.2%;日均直接结算4203人次,次均费用2.3万元,基金支付比例60.5%。
【泽璟制药】获批开展甲苯磺酸多纳非尼片与基石药业(苏州)有限公司的抗PD-L1 单克隆抗体CS1001联合治疗晚期实体瘤受试者的多中心、开放性、剂量探索和剂量扩展的Ⅰ/Ⅱ期临床研究。
【昭衍新药】(1)公司2020年一季度实现营业收入1.55亿元(+107.90%),归母净利润1914.70万元(+59.03%),扣非归母净利润1478.04万元(+223.57%)。(2)公司《2018年股票期权和限制性股票激励计划》授予的限制性股票第二个解除限售期解除限售条件已经成就,本次解除限售股票18.23万股,上市流通时间为2020 年5月11日。
【兴齐眼药】(1)公司董事、研发总监杨强拟减持股份合计不超过3.75万股。(2)“贝美前列素滴眼液” 收到药品注册受理通知书,用于降低开角型青光眼及高眼压症患者的眼压。
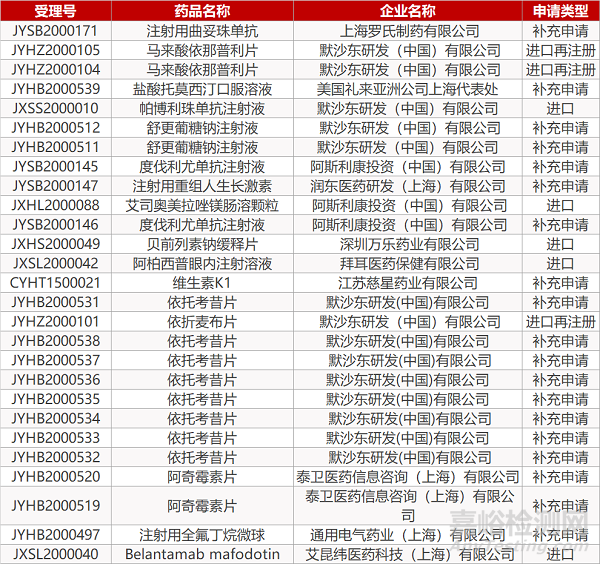
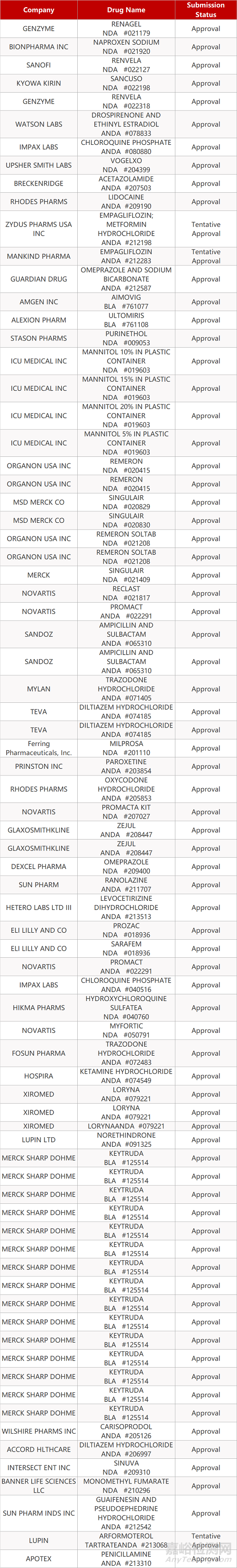
2. FDA最新获批情况(北美4月30日)
- The End -

来源:药研发


