您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-29 09:04
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
FDA批准帕金森病新药上市。Neurocrine 公司口服药物Ongentys(opicapone)获FDA批准,作为左旋多巴/卡比多巴的辅助疗法,治疗经历“关闭”期的帕金森病患者。Ongentys也是唯一一款获批的可减少“关闭”期时间且不会引起运动障碍的儿茶酚氧位甲基转移酶抑制剂。在2项Ⅲ期临床(BIPARK-1和BIPARK-2)中,与安慰剂相比,50mg Ongentys显著缩短了较基线时的“关闭”期时间,且患者运动能力正常的“开启”期时间也显著增长。
1.奥星药业氨酚羟考酮片上市申请获受理。奥星药业3类仿制药氨酚羟考酮片的上市申请获CDE受理。氨酚羟考酮片是由阿片类止痛药盐酸羟考酮及非甾体抗炎药对乙酰氨基酚组成的复方制剂,可用于各种原因引起的中、重度疼痛,包括癌症引起的疼痛。目前国内市场仅美国SpecGx公司进口的氨酚羟考酮片上市销售,其2018年中国公立医疗机构终端销售额超过4亿元;暂无国产仿制药获批上市,人福药业为该品种仿制药首家申报上市的企业。
2.豪森公布第三代EGFR-TKI阿美乐临床最新结果。豪森药业在AACR年会上公布第三代EGFR-TKI阿美乐(甲磺酸阿美替尼片)治疗EGFR T790M突变阳性的局部晚期/转移性非小细胞肺癌(NSCLC)的Ⅱ期临床最新结果。中位随访11.4个月时,阿美乐二线治疗这类患者疗效确切。总人群的ORR为68.9%(脑转移患者约为61%);总人群的疾病控制率DCR为93.4%,总体人群中位PFS为12.3个月(脑转移患者约为10.8个月);总体人群中位缓解持续时间DoR为12.4个月(脑转移患者约为11.3个月)。经独立评审委员会评估,该药在脑转移患者中疗效与总人群中相仿。临床试验中该药的耐受性和安全性良好。
3.恒瑞公布PD-1联合治疗SCLC Ⅱ期临床结果。恒瑞医药在AACR年会上公布PD-1卡瑞利珠单抗联合阿帕替尼治疗广泛期小细胞肺癌(SCLC)的Ⅱ期临床结果。研究纳入59例既往铂类耐药的广泛期SCLC患者,随机分为三组,分别是阿帕替尼375mg每日服用组、5天连服后停两天组和连服7天停7天组。卡瑞利珠单抗均为200mg/2周。结果显示,在阿帕替尼每日连服组中,ORR达到34%,中位PFS为3.6个月,中位OS为8.4个月。研究中治疗相关3级及以上AE发生率为72.9%,总体不良反应可管理。
4.亘喜生物即用型CAR-T细胞疗法最新临床数据。亘喜生物在AACR年会上公布其即用型CAR-T细胞疗法GC027治疗复发/难治急性T淋巴细胞白血病的Ⅰ期临床最新数据。数据显示,在治疗一个月后,4例患者的血液中均检测不到癌细胞,其中2例患者达到6个月后复查仍然没有发现癌细胞。第5例患者在两周时有良好的反应,但不久后出现复发。在安全性方面,上述4例获得积极响应的患者均发生了细胞因子释放综合征(CRS)。其中1例病人患有危及生命的CRS,其他3例患者出现的CRS虽不严重,但仍需要积极治疗。
5.诺华PI3K抑制剂在中国获批三项临床。诺华PI3K抑制剂Piqray(alpelisib,BYL719)在中国获得三项临床试验默示许可,适应症为“与氟维司群联合治疗应用于内分泌方案治疗中或治疗后出现疾病进展的激素受体阳性、HER2阴性、PIK3CA突变的晚期乳腺癌女性(绝经后)和男性患者。” Piqray是FDA批准的首款用于治疗乳腺癌的PI3K抑制剂。在中国,诺华已提交了多项BYL719的临床试验申请。据CDE公示信息,Piqray已在中国晚期非小细胞肺癌患者中完成了一项开放性的Ⅱ期研究。
6.三叶草新冠病毒疫苗项目获CEPI资助。流行病防范创新联盟(CEPI)与三叶草澳洲公司签署一项合作协议,向三叶草澳洲公司提供350万美元初始资金,帮助该公司在澳大利亚进行“COVID-19 S-三聚体” 新冠疫苗人体I期临床试验的准备和启动工作。“S-三聚体”疫苗由三叶草独特的蛋白质三聚体化(Trimer-Tag)专利技术平台开发,是一种新型冠状病毒表面抗原S蛋白三聚物亚单位候选疫苗。CEPI在惠康信托基金会和比尔与美琳达·盖茨基金会的支持下成立,是一个旨在通过加速疫苗研发防控流行病的新联盟。
7.中国第四款新冠疫苗获批临床。中国生物北京生物制品研究所与中国疾控中心病毒病预防控制所联合开发的新冠灭活疫苗获国家药监局临床批件,预计将于4月28日启动临床试验。这是第四款获批开展临床试验的国产新冠病毒疫苗,也是国药集团中国生物第二款进入临床试验的新冠病毒疫苗。目前,中国生物已在北京建设了年产能达1亿剂的新冠病毒疫苗生产车间,具备满足大规模紧急使用和常规接种的生产条件。
1.赛诺菲/再生元PD-1肺癌Ⅲ期临床提前终止。赛诺菲和再生元宣布,其PD-1抑制剂Libtayo (cemiplimab) 一线治疗肿瘤细胞PD-L1表达率大于等于50%的鳞状/非鳞状晚期非小细胞肺癌(NSCLC)的III期临床获积极结果。与含铂双药化疗相比,Libtayo显著延长患者的总生存期,将死亡风险降低32.4%。根据独立数据监查委员会的建议,两公司计划提前终止该项试验,使所有入组患者接受Libtayo治疗。Libtayo已获批用于转移性或局部晚期皮肤鳞状细胞癌成人患者。
2.Moderna递交新冠病毒疫苗Ⅱ期临床IND申请。Moderna公司已向FDA递交IND申请,计划启动该公司新冠病毒疫苗mRNA-1273的Ⅱ期临床试验。如果获批,该公司预计在今年第二季度启动Ⅱ期临床试验。这项研究预计注册纳入600名健康志愿者,包括300名18-55岁的成人和300名55岁以上的老年人。志愿者将间隔28天,接受两次mRNA-1273的疫苗(或安慰剂)注射,注射剂量为50微克或250微克。
3.武田EGFR抑制剂获突破性疗法认定。FDA授予武田(Takeda)制药在研EGFR/HER2抑制剂mobocertinib(TAK-788)突破性疗法认定,用于治疗携带EGFR外显子20插入突变、且接受铂基化疗后疾病依然进展的非小细胞肺癌(NSCLC)患者。一项Ⅰ/Ⅱ期临床结果表明,mobocertinib的治疗使这类NSCLC患者的中位无进展生存期达到7.3个月,总缓解率达到43%。2019年,FDA已授予mobocertinib孤儿药资格,治疗携带EGFR突变或HER2突变(包括外显子20插入突变)的肺癌患者。
4.再生元/赛诺菲更新IL-6抑制剂COVID-19项目试验结果。再生元和赛诺菲公布IL6受体抗体Kevzara(sarilumab)治疗COVID-19住院患者的Ⅱ/Ⅲ期试验的Ⅱ期阶段的初步结果。初步分析表明:Kevzara能迅速降低炎症关键标志物CRP;在危重(机械通气)患者中观察到的IL-6基线水平提高幅度大于重症患者;没有观察到使用Kevzara的安全性问题;重症组和危重组合并,与安慰剂组相比,Kevzara没有为临床结果带来显著改善,然而,在危重组中,接受400 mg Kevzara治疗的患者获得一定程度的改善,临床症状改善2级的患者比例为58%(安慰剂组为41%)。根据IDMC建议,该研究将修正方案,只有危重患者继续接受剂量为400 mg的Kevzara或安慰剂治疗。
5.Verastam 公司RAF/MEK/FAK抑制剂组合早期临床结果积极。Verastam Oncology公司在AACR年会上公布其RAF/MEK抑制剂VS-6766,和特异性FAK抑制剂defactinib联用,治疗携带RAS突变的实体瘤患者的Ⅰ期临床结果。试验结果表明,在携带KRAS突变的低级别浆液性卵巢癌患者队列中,组合疗法达到67%(4/6)的总缓解率。中位治疗时间为20.5个月。在携带KRAS突变的非小细胞肺癌患者中(n=10),8例患者疾病得到控制。
6.诺华MET抑制剂Ⅱ期临床结果积极。诺华在AACR年会上公布其MET抑制剂capmatinib治疗携带脑转移瘤的非小细胞肺癌(NSCLC)患者的初步数据。在13例可评估患者中,7例患者获得颅内缓解,其中4例患者大脑病变完全消失,总计12例患者的颅内疾病得到控制。此前,FDA曾授予capmatinib突破性疗法认定,并在今年2月授予它优先审评资格,适应症为治疗携带MET基因外显子14跳跃突变的晚期NSCLC患者。
1.印度停用中国新冠病毒检测试剂盒 中使馆回应。针对印度停用中国新冠病毒抗体快速检测试剂盒测试事件,中国驻印度使馆28日回应:万孚生物和珠海丽珠试剂股份有限公司已就此发表声明,强调其产品均已通过中国药监局审批,符合质量标准要求,也通过了印度医学研究理事会下属机构印度国家病毒研究所的验证,被认为是合格的产品。上述公司生产的检测试剂向欧洲等多个国家出口并获得了积极评价。并强调,新冠抗体检测试剂的储存、运输和使用均有严格要求,需要规范操作。
2.对医护人员开展定期测试可降低新冠病毒传播。英国科学家近日发布报告称,他们使用数学模型分析了一些策略对控制新冠病毒传播的效果,结果表明,对医护人员和其他高危人群(不管他们是否出现症状)每周开展一次PCR筛查,将使他们对新冠肺炎疫情传播的贡献降低25%—33%。该报告指出,医护人员新冠肺炎病例占所有报告病例的19%。科学家认为,针对高风险人群开展检测更有利于抑制新冠病毒的传播。
【恒瑞医药】公司近日收到国家药监局核准签发的关于非布司他片的《药品补充申请批件》,公司非布司他片通过仿制药一致性评价。
【上海莱士】(1)2020年Q1实现营业收入7.32亿元(+25.18%),归母净利润为3.11亿元(+41.97%),扣非归母净利润3.27亿元(+60.21%)。(2)提名彭玲、谭劲松、杨翠华为独立董事候选人。
【华仁药业】全资子公司华仁医疗拟在目前的净化厂房中改建3条熔喷无纺布生产线项目,总投资额不超过3000万元。
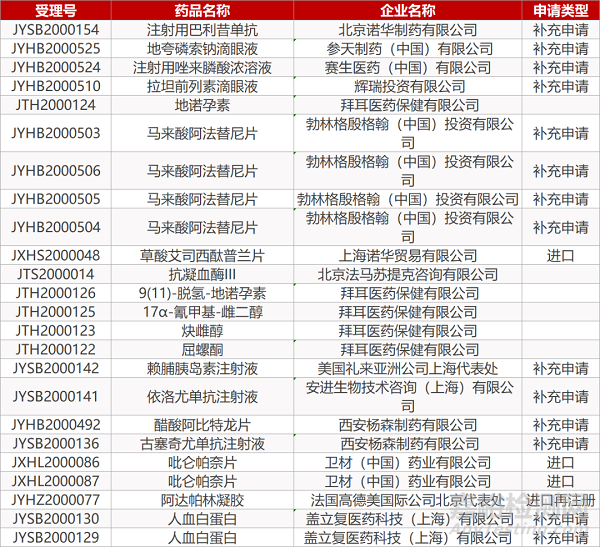
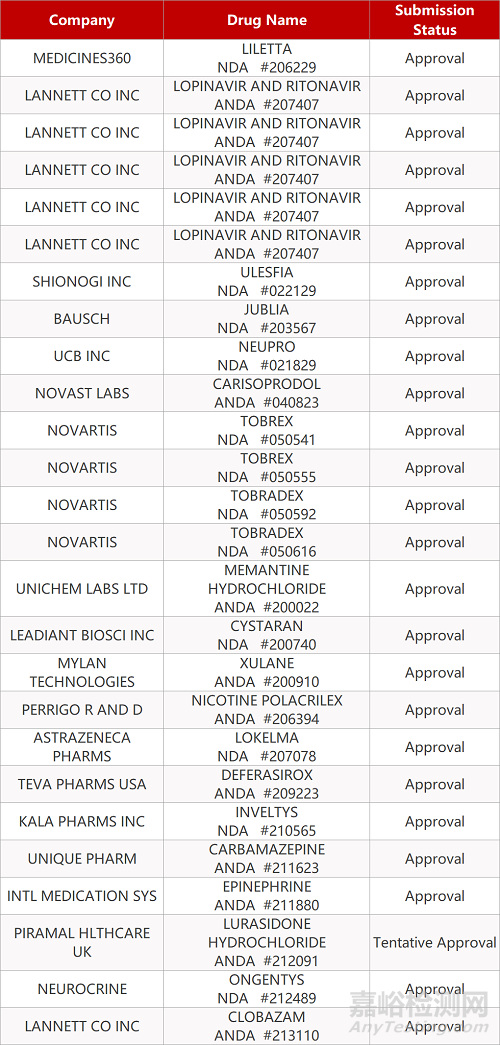
1. CDE最新受理情况(4月28日)
- The End -

来源:药研发


