您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-25 09:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
金花清感与连花清瘟治疗新冠数据公布。天津中医药大学校长张伯礼院士公布两个中成药——金花清感颗粒和连花清瘟胶囊治疗新冠肺炎的临床研究成果。在轻型和普通型患者中,和对照组相比,金花清感颗粒使患者转重症的比例下降2/3,退热时间缩短1.5天,并显著改善患者白细胞、中性粒细胞计数和淋巴细胞计数。在另一项284例患者参与的临床试验中,在主要临床症状的消失率、临床症状持续时间等方面,连花清瘟胶囊治疗组均优于对照组,治疗组肺部影像学好转达83.8%,对照组为64.1%;治疗组临床治愈达78.9%,对照组为66.2%;在轻症转重症方面,治疗组较对照组降低50%。
1.泽璟生物甲苯磺酸多纳非尼片申报上市。泽璟生物已向国家药监局提交甲苯磺酸多纳非尼片的新药上市申请,拟用于治疗不可手术或转移性肝细胞癌。该新药是一款口服多靶点、多激酶抑制剂类小分子抗肿瘤1类新药。本次新药上市申请主要是基于甲苯磺酸多纳非尼片一线治疗晚期肝细胞癌的一项II/III期临床研究(试验代号ZGDH3)的结果。目前,多纳非尼治疗晚期结直肠癌和碘难治性分化型甲状腺癌的Ⅲ期临床、以及多纳非尼与抗PD-1单抗联合治疗晚期肝细胞癌等多种恶性肿瘤的临床研究正在进行之中。
2.亚盛医药Bcl-2抑制剂首例患者给药。亚盛医药在研Bcl-2选择性抑制剂APG-2575单药或联合治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤( CLL/SLL) 的全球Ib/II期研究在美国完成首例患者给药。该项研究为全球多中心、开放性Ib/II期剂量疗效探索研究,旨在评估APG-2575单药或者联合rituximab/acalabrutinib治疗R/R CLL/SLL患者的安全性、耐受性,并初步评估有效性。APG-2575是一款新型口服Bcl-2选择性小分子抑制剂,拟用于治疗多种血液恶性肿瘤。
3.泰德制药1类创新药临床申请获FDA受理。泰德制药新型ROCK2高选择性抑制剂TDI01的临床申请获FDA受理,拟开展适应症为非酒精性脂肪肝炎和肺纤维化。据悉,TDI01可通过抑制ROCK2,同时具有抑制纤维化进程、抗炎和免疫调节作用,对纤维化发生发展各个环节均有治疗作用。目前,非酒精性脂肪肝炎导致肝纤维化全球尚无获批品种,各种间质性肺病导致的肺纤维化治疗手段有限,全新靶点的TDI01有望提供新的治疗选择。
4.复宏汉霖发布2019年度业绩报告。复宏汉霖公布2019年全年业绩,实现营业收入约人民币9090万元。2019年2月,该公司研制的首款产品汉利康®正式获批上市,成为国内首个生物类似药。自2019年5月开出首张处方,汉利康®7个月的总销售额约人民币1.9亿元,复宏汉霖实现销售分成收入人民币0.79亿元。研发创新方面,2019年累计研发支出约人民币14.07亿元,较2018年增长44.66%,主要用于产品线扩充、临床前研究投入等。
1.艾伯维放弃HIV组合药物Kaletra专利。据英国《金融时报》等媒体报道,为应对COVID-19大流行,艾伯维决定放弃HIV组合药物克立芝(Kaletra,Lopinavir/ritonavir)的专利权,以面对可能威胁全球的药物供应短缺问题。目前针对Kaletra治疗COVID-19的一系列临床试验正在进行中,但其有效性仍无法确定。来自中国的数据显示,洛匹那韦/利托那韦在一项199例COVID-19患者参与的临床试验中失败。在治疗第28天Kaletra组患者的死亡率为15%,安慰剂组为27.1%。上周《新英格兰医学》杂志上发表的评论指出,对于重症COVID-19患者,Kaletra在改善临床症状、延长寿命等方面均不是最高标准的治疗方案,对疾病的进展没有影响;建议该药物与其他抗病毒药物联合使用可能会更好。
2.Myovant口服药relugolix欧盟申报上市。专注于女性健康和前列腺癌疾病领域的药物研发公司Myovant宣布,已向欧洲药品管理局(EMA)提交了relugolix复方片(relugolix 40mg、雌二醇1.0mg、醋酸炔诺酮0.5mg)的上市申请,用于一日一片治疗子宫肌瘤女性的中重度症状。relugolix是由武田和Myovant公司(Roivant和武田组建的公司)联合开发的促性腺激素释放激素(GnRH)受体拮抗剂。除子宫肌瘤和子宫内膜异位症外,Myovant公司也正在开发relugolix单药片剂(120mg)用于治疗晚期前列腺癌。
3.武田四价登革热疫苗TAK-003两项研究成果发布。武田在《柳叶刀》上发表了四价登革热疫苗TAK-003两项(关键III期TIDES试验和II期DEN-204试验)研究成果。其中TIDES试验的18个月数据分析包括总疫苗效力(VE)的更新和按血清型、基线血清状态、疾病严重程度(第二针[第一针免疫后3个月]免疫后18个月)对次要疗效终点的正式评估,结果证实了TAK-003在4-16岁儿童中对经病毒学证实的登革热保护作用(总体VE为73.3%[95%CI:66.5%-78.8%])。两项试验的分析结果与先前报道的TAK-003的安全性、免疫原性和疗效数据一致。
4.AXSAXS-05治疗AD相关激越II/III期试验加速完成。Axsome公司宣布正在加速完成AXS-05(右美沙芬/安非他酮调释剂)用于阿尔茨海默氏症(AD)患者治疗激越(agitation)的II/III期ADVANCE-1试验,以确保在新冠肺炎大流行期间这一患者群体的安全,同时保持临床试验的完整性。目前AXS-05组和安慰剂组已完成患者入组,该试验的顶线结果预计2020年第二季度初公布。AXS-05是一种新型NMDA受体拮抗剂,已获FDA授予治疗重度抑郁症的突破性药物资格,以及治疗难治性抑郁症和AD相关激越的快速通道资格。
5.Biohaven偏头痛喷剂vazegepant进入III期临床。Biohaven公司宣布已完成与FDA关于vazegepant鼻内给药用于偏头痛急性治疗II期临床和非临床的互动,并成功将10mg vazegepant鼻内给药方案推进至III期临床阶段。vazegepant是一款第三代小分子CGRP受体拮抗剂。在II/III期剂量发现试验中,与安慰剂相比,10mg和20mg剂量vazegepant鼻内方案在给药后2小时消除疼痛和最烦人症状的共同主要终点方面具有统计学意义的改善;而且vazegepant鼻内给药15分钟后疼痛缓解、30分钟后恢复正常功能、持续获益48小时。
6.吉利德瑞德西韦获FDA孤儿药资格。3月23日,FDA授予吉利德开发的在研抗病毒疗法瑞德西韦(remdesivir)孤儿药资格,其适应症为冠状病毒疾病2019(COVID-19)。瑞德西韦是一款抗病毒疗法,其作用机制为抑制RNA依赖性RNA聚合酶的活性,从而抑制RNA病毒的增殖。目前,吉利德正在开展六项临床试验,检验瑞德西韦治疗不同类型的COVID-19患者的疗效。其中,在中国进行的两项临床试验有望在4月获得结果。
1.Nature重磅:超过6成新冠患者无症状。3月20日,国际顶尖学术期刊 Nature 发表了题为:Covert coronavirus infections could be seeding new outbreaks 的报告,指出30%-60%的新冠感染者无症状或者症状轻微,但他们传播病毒的能力并不低,这些隐性感染者可能会引发新一轮的疫情大爆发。研究人员表示,关闭学校、取消公共聚会,让人们呆在家里,远离公共场所,这些有力的社会隔离措施是阻止这些无症状病例传播的唯一途径。
2.美国CDC:COVID-19年轻患者住院比例超预期。来自美国疾病控制和预防中心的一份最新报告表明,任何年龄段的患者都可能因COVID-19发生导致住院的严重疾病,并且年轻人因病情严重而住院的比例远远超过预期。报告显示近40% COVID-19住院患者年龄在55岁以下。报告同时指出,老年人因COVID-19导致严重疾病和死亡的风险更高,31%的确诊病例、45%的住院病例、53%的ICU入住病例和80%的死亡病例发生在65岁以上的群体中。
3.九成以上新冠病人使用中医药。3月23日,在湖北武汉举行的新闻发布会上,国家中医药管理局党组书记余艳红介绍,全国新冠肺炎确诊病例中,有74187人使用了中医药,占91.5%;其中,湖北省有61449人使用了中医药,占90.6%。临床疗效观察显示,中医药总有效率达到90%以上。在临床对照研究中,目前已筛选出金花清感颗粒、连花清瘟胶囊、血必净注射液和清肺排毒汤、化湿败毒方、宣肺败毒方等有明显疗效的“三药三方”。
4.江西援鄂人员高级职称集中评。《江西援鄂医务人员高级职称集中优先评审工作方案》发布,对江西省援助湖北医务人员卫生高级职称评审工作实行单独组织、集中评审。《方案》明确,评审对象为江西统一选派援助湖北医务人员中符合申报条件的人员。申报职称不受单位岗位结构比例限制;允许提前一年申报高级职称;对职称外语、计算机应用能力不作要求,免于参加专业实践能力考核,视同完成基层服务工作年限和2020年度继续教育学时学分。
【健友股份】子公司香港健友的注射用硼替佐米申报的ANDA申请以获得FDA暂时批准。目前本品包括原研在内的同规格国内获批企业有六家,包括:齐鲁制药、江苏豪森、正大天晴、南京正大天晴、南京先声。经查IMS数据库,2019年注射用硼替佐米美国销售额约为6.35亿美元。
【国药一致】2019年度实现营业收入520.46亿元(20.69%),实现归母净利润12.71亿元(5.00%)。
【哈三联】公司及其全资子公司兰西制药自2020年2月20日至2020年3月23日期间,累计收到政府补助资金共计2,337.92万元。
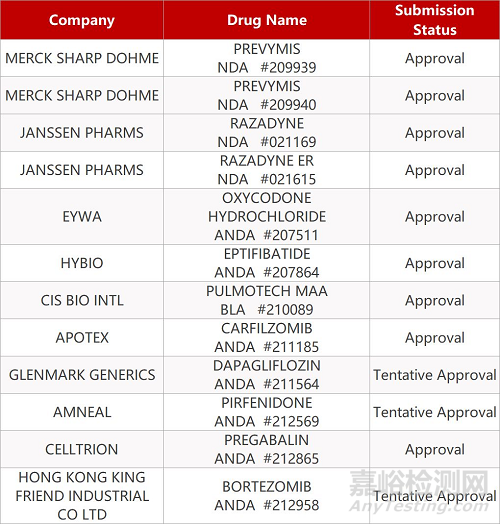
2. FDA最新获批情况(北美3月23日)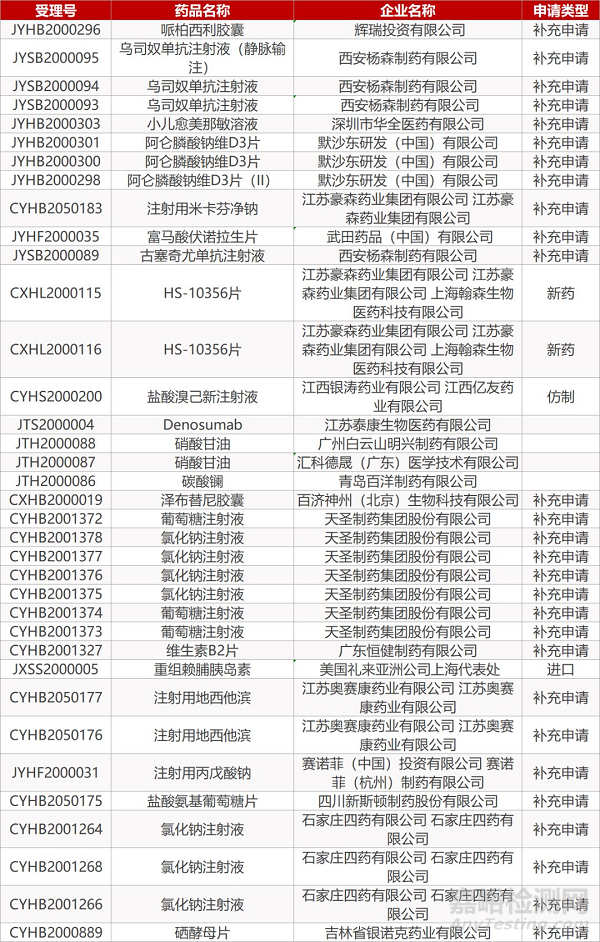
- The End -

来源:药研发


