您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-20 10:01
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
COVID-19致临床试验受阻,FDA发布应对指南。FDA发布COVID-19疫情期间针对行业、研究人员和机构审查委员会进行临床试验的新指南。对于正在进行的试验,指南建议申办者应考虑每种情况,重点关注对试验参与者安全性的潜在影响,并相应地修改研究行为;对暂停试验参与者应提供额外安全监控。对所有受COVID-19影响的试验,申办者应在临床研究报告加以描述,包括研究中断期间实施的应急措施;已实施的应急措施的分析和相应讨论,如试验参与者退出研究、使用替代程序等对安全性和功效结果的影响等。
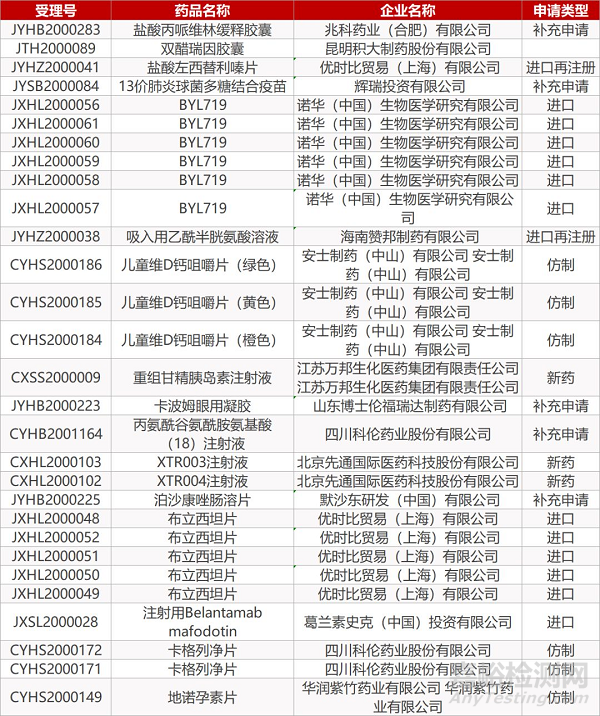
1.正大天晴达比加群酯胶囊首仿获批。3月18日,正大天晴按新4 类申报的达比加群酯胶囊获国家药监局批准,视同通过一致性评价,为国内首家。达比加群酯胶囊是新一代非维生素K拮抗剂类口服抗凝药物,用于预防非瓣膜性房颤患者的卒中和全身性栓塞。其原研产品为勃林格殷格翰的Pradaxa,2018年销售额达到14.86亿欧元。目前,该原研药已获批进口中国,成都倍特、江苏豪森、成都苑东3家企业的同类产品正在申报上市。
2.银谷制药苯环喹溴铵鼻用喷雾剂获批上市。3月18日,银谷制药1类新药苯环喹溴铵鼻用喷雾剂获国家药监局批准上市,适应症为过敏性鼻炎。苯环喹溴铵鼻用喷雾剂是银谷制药自主研发的一种新型高选择性的M胆碱能受体拮抗剂,具毒副作用低,使用安全,适用人群广泛等特点。据悉,银谷制药正在开展评估苯环喹溴铵吸入用气雾剂用于慢性阻塞性肺疾病(COPD)的临床研究。
3.普什制药氯化钠滴眼液通过一致性评价。3月18日,普什制药按新4类申报的氯化钠滴眼液获国家药监局批准上市,视同通过一致性评价,成为该品种国内首个通过一致性评价的产品,也是成都普什制药第2个通过一致性评价的滴眼液。氯化钠滴眼液临床上主要用于暂时性缓解眼部干涩症状。
4.石四药盐酸罗哌卡因注射液通过一致性评价。石四药4类仿制药盐酸罗哌卡因注射液获国家药监局批准上市,视同通过一致性评价。罗哌卡因(Naropin)是阿斯利康开发的一款纯左旋体长效酰胺类局麻药,临床适用于外科手术麻醉(硬膜外麻醉,包括剖宫产术,区域阻滞)、急性疼痛控制(持续硬膜外输注或间歇性单次用药,如术后或分娩镇痛,区域阻滞)。除阿斯利康外,国内该品种获批的生产厂家还有恒瑞、人福和齐鲁等10家药企。
5.洛匹那韦/利托那韦治疗严重新冠疾病未达临床终点。中日友好医院曹彬教授研究团队使用洛匹那韦/利托那韦组合治疗COVID-19患者的研究结果发表在《新英格兰医学杂志》上。试验结果显示,洛匹那韦/利托那韦与标准护理相比,在中位临床改善所需时间方面并没有提供显著益处,两者均为16天(临床改善风险比1.31,95% CI,0.95-1.85,P=0.09);治疗组患者的28天死亡率低于对照组(19.2%vs25.0%);两组在安全性方面结果相似。研究中没有发现洛匹那韦/利托那韦能够显著降低患者体内病毒RNA的载荷。
6.葆元生物1类抗癌药获批临床。葆元生物独家引进品种AB-106胶囊获国家药监局两项临床试验默示许可,一项拟开展的适应症为携带NTRK1、NTRK2、NTRK3融合基因的不分瘤种的实体瘤;另一项拟开展适应症为携带ROS1融合基因的非小细胞肺癌(NSCLC)。AB-106是日本第一三共制药开发的一款高选择性ROS1/NTRK双靶点小分子抑制剂,已在日本和美国完成Ⅰ期临床试验,用于治疗含有ROS1或NTRK融合基因实体瘤和神经内分泌肿瘤患者。该公司计划于2020年第一季度在中国和美国开展Ⅱ期临床试验。
1.辉瑞20价肺炎球菌结合疫苗III期临床达终点。辉瑞20价肺炎球菌结合疫苗(20vPnC)PF-06482077在III期临床(NCT03760146)研究中达主要终点指标。接种疫苗后一个月,在≥60岁老年人群中,20vPnC针对20种血清型的免疫原性与Prevnar 13中全部13种血清型的免疫原性以及PPSV23中额外7种新血清型中的6种血清型免疫原性具有非劣效性,与PPSV23中额外7种新血清型中的另一种血清型以小幅度差异未达到免疫原性非劣效性标准。除此之外,在18--64岁人群中,全部20种血清型的免疫原性均达到非劣效性标准。预计今年年底前向FDA提交20vPnC成人适应症的上市申请。
2.口服MPO抑制剂获快速通道资格。Biohaven公司髓过氧化物酶抑制剂verdiperstat(BHV-3241)获FDA授予治疗多系统萎缩(MSA)症的快速通道资格。在一项Ⅱa期临床中,经过12周的治疗后,安慰剂组患者MSA评定量表测量评分下降了4.6分,而300 mg 、600 mg BHV3241治疗组患者的分数分别下降了3.7分、2.6分。综合自主症状评分等测量结果也得到相应的改善。这些临床发现与在动物模型中观察到的verdiperstat的神经保护作用一致。Verdiperstat显著降低了人体血液中的MPO活性。目前该药已获FDA和欧盟授予的孤儿药资格。
3.罗氏托珠单抗治疗新冠肺炎全球Ⅲ期临床启动。3月19日,罗氏启动一项全球Ⅲ期临床试验,评估托珠单抗(Actemra/RoActemra)与安慰剂加标准治疗相比,治疗重症COVID-19肺炎成人患者的安全与有效性。预计将于4月初开始入组,全球范围内招募约330例患者;主要和次要终点包括临床状态、死亡率、机械通气和重症监护室 (ICU) 变量。托珠单抗是首个获批的抗IL-6受体拮抗剂,已获批用于治疗中重度活动性类风湿性关节炎。
4.世卫组织启动大型全球性COVID-19临床试验。WHO将组织开展一项全球临床试验SOLIDARITY,检测多项候选疗法治疗COVID-19患者的疗效。目前阿根廷、巴林、加拿大、法国、伊朗、挪威、南非、西班牙、瑞士和泰国等国家已确认加入。该研究包含一个对照组和4个治疗组。对照组的患者将接受所在国的标准护理,其它4个治疗组将接受瑞德西韦、洛匹那韦/利托那韦、洛匹那韦/利托那韦+干扰素β(IFN-β)或氯喹的治疗。试验将专注于和改善患者健康相关的关键性因素,包括死亡率,使用机械通气或重症监护病房(ICU)的几率以及住院的时间。
5.辉瑞与IDEAYA达成一项临床研发合作。IDEAYA Biosciences公司在研蛋白激酶C(PKC)小分子抑制剂IDE196与辉瑞MEK抑制剂binimetinib拟联合开展用于治疗携带GNAQ或GNA11基因突变的实体瘤的临床研究,这些实体瘤包括转移性葡萄膜黑色素瘤(MUM),皮肤黑色素瘤和结直肠癌(CRC)。两家公司将就临床试验结果进行联合决策和数据共享。IDEAYA将赞助这项研究,辉瑞公司将为该研究提供binimetinib。该试验预计将在2020年中期开始。
1.2020中国大健康民营企业百强榜发布。3月18日,胡润研究院发布《2020胡润中国百强大健康民营企业》排位榜。榜单显示,医药行业上榜企业最多,有62家(其中专注于生物医药的有19家);医疗设备和医疗服务紧随其后,分别有17家和15家。榜单前十名企业价值均过千亿,覆盖药物研发生产、医疗设备企业、药物研发服务平台等领域。其中恒瑞医药以3,720亿市值荣登榜首,位居第二至第五位企业分别为迈瑞医疗、药明康德、阿里健康和扬子江药业。
2.英美澳多国科学家发表新冠病毒起源于自然的多个证据。权威学术期刊《自然-医学》日前刊登了一篇有关病毒起源的重要文章。包括美国等多国研究机构的科学家们,根据已发表的数据得出多项自然选择的证据,明确提出SARS-CoV-2冠状病毒不是实验室产物,源于自然进化过程。文章通讯作者Kristian Andersen教授来自美国斯克利普斯研究所,合作者包括美国杜兰大学的Robert Garry教授、澳大利亚悉尼大学的Edward Holmes教授、英国爱丁堡大学的Andrew Rambaut和美国哥伦比亚大学的W. Ian Lipkin教授,均为知名的病毒学或流行病学研究者。
3.我国首次无新增本土确诊病例。3月18日0时—24时,我国首次无新增本土确诊病例。湖北以外省份,无新增死亡病例,重症病例减少2例,已连续7日无新增本土确诊病例;湖北除武汉外,连续14日无新增本土确诊病例。18日,新增报告境外输入确诊病例34例,其中北京21例,广东9例,上海2例,黑龙江1例,浙江1例。截至3月18日24时,累计报告境外输入确诊病例189例。最近7日,境外输入确诊病例数占新增确诊病例总数的84.55%。
【诚意药业】公司的“盐酸氨基葡萄糖胶囊(规格480mg和750mg)”已通过仿制药质量和疗效一致性评价。
【科伦药业】截至2020年3月19日,公司股东王晶翼增持公司股份35.22万股(公司总股本的0.024%)。
【泰合健康】公司全称由“成都泰合健康科技集团股份有限公司”变更为“成都华神科技集团股份有限公司”,证券简称由“泰合健康”变更为“华神科技”。
- The End -

来源:药研发


