您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-24 10:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
Opdivo在日获批治疗食管癌。百时美施贵宝宣布,日本厚生劳动省已批准其重磅PD-1抑制剂Opdivo(nivolumab)治疗无法切除的晚期/复发性食管癌患者,这些患者在化疗后疾病依然进展。这是Opdivo首次获批用于治疗晚期食管癌患者,也是日本首款食管癌免疫疗法。在一项Ⅲ期ATTRACTION-3试验中,与化疗(多西他赛或紫杉醇)相比,Opdivo治疗对氟嘧啶和含铂药物联合疗法不耐受的,无法切除的晚期/复发性食管鳞状细胞癌患者的总生存期显示出统计学意义的显著获益,将死亡风险降低23%,并将患者的中位生存期延长了2.5个月。
1.宜昌人福盐酸阿芬太尼即将获批上市。人福医药3类仿制药盐酸阿芬太尼注射液的上市申请审批状态已处于"在审批"状态,预计将于近期获批上市,成为国内首个获批上市的阿芬太尼药物。盐酸阿芬太尼是一种芬太尼的类似物,主要作用于μ阿片受体,为麻醉时用的短效强镇痛药,适用于短小手术。盐酸阿芬太尼1983年在荷兰首次上市,1987年被引入美国市场,目前我国尚无此药品获批上市。
2.海思科1类静脉麻醉新药拟纳入优先审评。海思科旗下环泊酚乳状注射液的上市申请获国家药监局拟纳入拟优先审评公示名单。环泊酚是海思科公司开发的一种全新的具有自主知识产权的静脉麻醉药物,拟用于手术全麻诱导、内镜诊疗的镇静/麻醉、ICU 镇静等适应症,本次被纳入拟优先审评的适应症为“全身麻醉诱导”。据悉,海思科还计划在美国开展临床试验,该公司已于2019年7月31日与FDA召开了Pre-IND会议。
3.正大丰海依达拉奉新增适应症申请获受理。中国生物旗下正大丰海的脑神经保护剂“依达拉奉氯化钠注射液”(依必坦)的新适应症上市申请已获国家药监局受理,申请新增的适应症为:肌萎缩性嵴髓侧索硬化(ALS)。该药原研药由田边三菱制药开发,2019年7月获批进口中国。依达拉奉注射液国内获批的生产厂家有先声东元制药、博大制药等超过20家,依达拉奉氯化钠注射液仅有正大丰海一家。米内网数据,2018年中国公立医疗机构终端依达拉奉销售额超过50亿元。
4.和铂医药引进品种抗FcRn抗体完成临床Ⅰ期研究。2月21日,和铂医药宣布已完成全人源抗FcRn抗体HBM9161的临床Ⅰ期研究。HBM9161是HanAll Biopharma开发的一款全球首创、靶向新生儿Fc受体(FcRn)的抗体药物,和铂医药拥有其在大中华区开发、制造和商业化的权利。研究结果显示其药代动力学特征及降低IgG的药效结果与合作方在加拿大开展的临床研究结果一致,其安全性与之前的研究类似。和铂医药计划今年启动针对包括原发免疫性血小板减少症、重症肌无力、Grave's眼病、视神经脊髓炎谱系疾病等自身免疫性疾病的临床研究。
5.恒瑞双抗SHR-1701治疗鼻咽癌I期临床启动。2月20日,恒瑞登记启动其PD-L1/TGF-β双特异性抗体SHR-1701治疗复发或转移鼻咽癌患者的安全性和耐受性的Ib期临床研究。该研究为开放、非随机、单臂试验,主要终点为SHR-1701的安全性;次要终点为:客观缓解率,缓解持续时间,疾病控制率,无进展生存期,总生存时间。SHR-1701与默沙东在研双特异性抗体M7824具有相同靶点,属于升级版PD-1抑制剂。
6.仁会生物拟科创板IPO。上海仁会生物拟IPO融资30.05亿元申请在科创板上市。仁会生物成立于1999年1月,专注于创新生物药自主研发和产业化。目前拥有一款已上市产品--糖尿病治疗药物贝那鲁肽注射液(谊生泰),以及BEM-014和BEM-050等多款在研产品。治疗领域包括肥胖症、非酒精性脂肪性肝炎、2型糖尿病、抗凝血、实体瘤等。本次募资将用于新药研发项目、转化医学平台项目、结构生物学引领的药物发现平台项目、二期建设项目和补充流动资金及归还银行贷款。
1.礼来降糖药Trulicity新适应症获批。礼来Trulicity(度拉糖肽)新适应症获FDA批准,用于降低伴有心血管疾病或具有多重心血管风险因子的成人2型糖尿病(T2DM)患者的主要心血管事件风险。Trulicity也是唯一一个可以用于T2DM患者一级预防和二级预防以降低主要心血管事件风险的降糖药。在一项9901例患者(基线HbA1c为7.3%,其中68.5%无确诊的心血管疾病)参与的临床REWIND研究中,Trulicity联合标准护理能够将患者的主要心血管复合终点事件发生风险降低12%(P=0.026),非致死性脑卒中风险显著降低24%(P=0.017),心血管相关死亡风险降低但无显著性差异。
2.Esperion口服非他汀类降胆固醇新药获FDA批准。Esperion公司“first-in-class” ATP柠檬酸裂解酶(ACL)抑制剂Nexletol(bempeoic acid)获FDA批准,作为饮食和最大耐受剂量他汀疗法的辅助疗法,治疗杂合体家族性高胆固醇血症成人患者,或者需要进一步降低低密度脂蛋白胆固醇(LDL-C)的动脉粥样硬化性心血管疾病患者。Nexletol是一种非他汀类的口服降胆固醇疗法。四项Ⅲ期临床的汇总分析表明,在高胆固醇血症患者中,在接受最高耐受剂量的他汀疗法之上,bempedoic acid能够将LDL-C水平进一步降低18%。在无法耐受他汀疗法的患者中,bempedoic acid与安慰剂相比将LDL-C水平降低25%。
3.BioMarin血友病基因疗法获优先审评资格。BioMarin Pharmaceutical宣布,FDA受理其拟用于治疗A型血友病的基因疗法valoctocogene roxaparvovec递交的上市申请,并授予了优先审评资格,预计将于今年8月21日前做出回复。Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法,如果获批,这将是美国批准的治疗血友病的首款基因疗法。在一项Ⅰ/Ⅱ期临床中,患者接受一次剂量为6e13 vg/kg的基因疗法治疗,治疗后第三年,年出血率(ABR)和使用因子VIII的需求继续得到控制。在3年的治疗期间,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射。
4.Karyopharm创新机制抗癌药获FDA优先审评。Karyopharm公司开发的“first-in-class”选择性核输出抑制剂(SINE)Xpovio(selinexor)的补充新药申请(sNDA)获FDA受理,该申请寻求加速批准Xpovio治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者。FDA同时授予其优先审评资格,预计于6月23日前做出回复。在一项Ⅱb期临床SADAL试验中,Xpovio治疗R/R DLBCL患者的总缓解率达到28.3%,其中完全缓解率达到10.2%。患者的中位缓解持续时间为9.2个月。Xpovio已于去年获FDA批准用于治疗复发/难治性多发性骨髓瘤患者。德琪医药拥有该新药在中国大陆和澳门的开发和推广权益。
5.GSK与Immatics Biotechnologies合作开发新一代T细胞疗法。癌症免疫疗法研发公司mmatics Biotechnologies与葛兰素史克(GSK)将联合开发主要针对实体瘤的新一代过继性细胞疗法(ACT)。根据协议,Immatics将负责两个TCR疗法的开发和验证,直至确定临床候选药物为止;GSK将继续负责候选药物的进一步全球开发,制造和推广;Immatics将获得4500万欧元(约5000万美元)的预付款,并有资格就每种TCR疗法获得超过5.5亿美元的潜在里程碑付款,以及药物在未来的销售额分成。双方最初将聚焦于开发自体TCR-T细胞疗法,GSK有权选择利用Immatics的技术平台开发同种异体细胞疗法。
1.科学家揭示新冠病毒S蛋白高清结构。顶尖学术期刊《科学》在线发表了一篇关于新冠病毒的最新研究论文。来自德克萨斯大学奥斯汀分校(UT Austin)的一支团队利用冷冻电镜技术,揭示了新冠病毒表面S蛋白三聚体的3D高清结构【辨率达3.5埃(1埃 = 0.1纳米)】。这一信息对于我们了解新冠病毒如何识别和进入细胞,以及如何对其设计有效的疗法或疫苗,有着重要的指导意义。该研究还发现,与SARS病毒S蛋白相比,新冠病毒S蛋白膜外结构域与ACE2的结合能力更强(10-20倍)。
2.瑞德西韦临床试验结果不久将公布。2月21日,在国务院应对新冠疫情联防联控机制举行的新闻发布会上,科技部副部长徐南平表示,瑞德西韦正在武汉10家医院进行比较大规模的临床试验,已入组200多例重症和危重症患者,30多例轻型患者。此项临床试验是双盲试验,目前尚未揭盲。同日,世卫组织称,瑞德西韦等两项新冠临床试验预计在三周内有初步结果。据不完全统计,目前国内有博瑞医药、科伦药业、科本药业、海南海药4家企业官宣正在仿制瑞德西韦。
3.上海医生发明“一次性防飞溅隔离巾”。2月20日上午10时,由上海交通大学医学院附属第九人民医院发明的“一次性防飞溅隔离巾”样品,在一个小时里被赶制了出来。该隔离巾由防护材料和透明材料等组合而成,预设有两对袖套式操作口,既能保证良好的视野,又提供了一定的操作自由度,方便医护人员实施临床治疗,可显著降低手术和操作过程中的感染暴露风险,以满足医护人员的安全防护要求。
4.血浆治疗可较大范围应用。在2月21日举行的国务院应对新型冠状病毒肺炎疫情联防联控机制新闻发布会上,科技部副部长徐南平表示,截至2月20日,已有超过100名康复者捐献血浆,能制备240份左右的治疗用血浆,能够对超过200位重型或者危重型患者进行救治,较大范围应用恢复期血浆救治的条件已经具备。
【迈克生物】公司新型冠状病毒(2019-nCoV)核酸三重检测试剂盒已进入应急审批通道;新型冠状病毒IgG和IgM抗体检测试剂盒(直接化学发光法)、新型冠状病毒(SARS-Cov-2)IgG/IgM抗体检测试剂盒(胶体金法)目前正在临床验证中。
【海尔生物】2019年度公司实现营业收入101,252.04万元,较上年同期增长20.30%;营业利润21,574.81万元,较上年同期增长59.15%;利润总额21,108.63万元,较上年同期增长51.67%;归属于上市公司股东的净利润18,206.16万元,较上年同期增长59.76%。
【美年健康】1)公司拟向杭州艾迪康采购艾迪康医学检验信息管理软件并签署《软件购买合同》,本次交易构成关联交易。2)公司全资子公司美年大健康及其下属公司向深博医疗采购自动乳腺超声系统设备及配套隔膜框架并签署《采购框架协议》,本次交易构成关联交易。
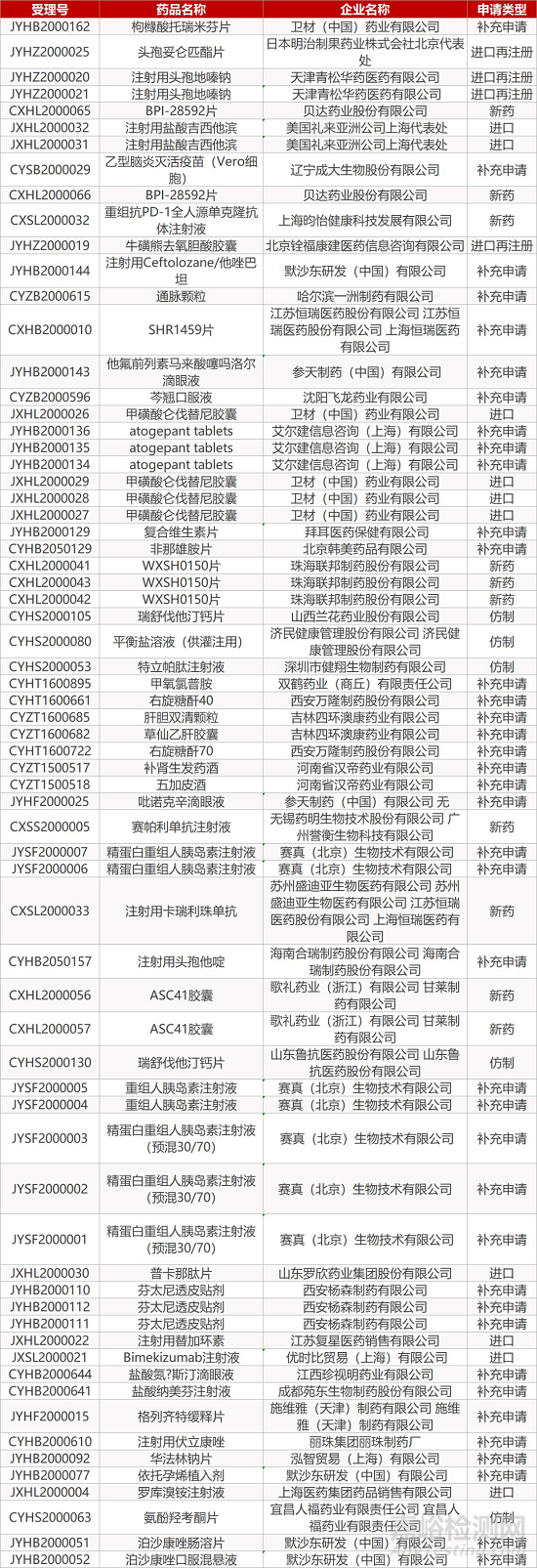
1. CDE最新受理情况(2月23日)
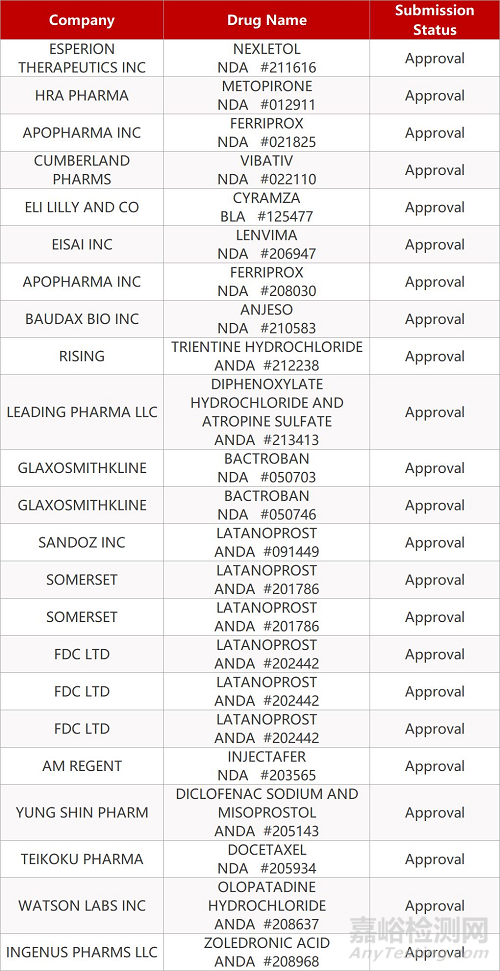
2. FDA最新获批情况(北美2月20日)

来源:药研发


