您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-01-10 09:04
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
Keytruda获FDA批准治疗特定高危膀胱癌患者。默沙东重磅PD-1抑制剂Keytruda治疗特定高风险非肌肉浸润性膀胱癌患者的新适应症获FDA批准。这些患者携带原位癌(CIS)且对卡介苗(BCG)疗法无响应,不愿或不能接受膀胱切除术。Keytruda此前已经获批20多项适应症,其中包括治疗晚期或转移性尿路上皮癌患者。一项多中心单臂临床KEYNOTE-057结果表明,在96例对BCG无响应的高危患者中,Keytruda达到41%的完全缓解率(95% CI:31,51),达到完全缓解的患者中,中位缓解持续时间为16.2个月。46%的患者完全缓解时间超过12个月。这也是获批治疗此类患者的首款PD-1抑制剂。
国内药讯
1.众生药业氢溴酸右美沙芬片首家通过一致性评价。众生药业旗下氢溴酸右美沙芬片获国家药监局核发的《药品补充申请批件》,成为该品种首家通过一致性评价的产品。氢溴酸右美沙芬片为镇咳类非处方药药品,属于甲类非处方药,适用于干咳,包括上呼吸道感染、支气管炎等引起的咳嗽。右美沙芬是2019年医保目录中4种不含复方祛痰药的镇咳药中的一种,2018年中国城市公立医院化学药终端该品种销售额在这4种镇咳药中排名第一。
2.齐鲁注射用比伐芦定即将获批。齐鲁制药3类仿制药注射用比伐芦定的审评审批状态变更为“在审批”,预计将于近期获批,齐鲁制药有望拿下该品种的首仿。注射用比伐芦定是一种抗凝血剂(凝血酶抑制剂),有助于防止血栓的形成,主要用于预防血管成型介入治疗不稳定性心绞痛,治疗前后的缺血性并发症。米内网数据显示,2018年中国公立医疗机构终端比伐芦定销售额为3.91亿元,其中,信立泰占据85.67%的市场份额,豪森药业占比14.33%。
3.基石PD-L1食管鳞癌Ⅲ期试验进展。基石药业抗PD-L1单抗CS1001联合化疗(氟尿嘧啶和顺铂)一线治疗晚期食管鳞癌的Ⅲ期临床GEMSTONE-304首例患者给药。该研究旨在评估这一组合方案的疗效和安全性。基石药业在2019年中国临床肿瘤学会年会上公布的一项Ⅰb期临床数据显示,CS1001联合化疗一线治疗食管鳞癌的ORR达到77.8%,且缓解可持续,同时总体安全性及耐受性良好。目前CS1001正在多项临床试验中用于治疗肝细胞癌、非小细胞肺癌以及淋巴癌等多个癌种。
4.信达生物TIGIT抗体获批临床。信达生物在研TIGIT抗体IBI939获国家药监局临床试验默示许可,适应症为:晚期肿瘤(血液肿瘤和实体瘤)。这是首个在国内获批临床的TIGIT抑制剂。全球范围内尚无针对该靶点的药物获批上市。Clinicaltrials.gov网站信息显示,已经有多项登记的临床试验在评估TIGIT抗体单药或与其它的药物联合用药在多种癌症中的疗效,涉及到的TIGIT抗体包括:BMS的BMS-986207、OncoMed 公司的OMP-313M32、默沙东的MK-7684、基因泰克的MTIG7192A、Arcus Biosciences的AB154等。除信达生物外,国内还有百济神州、复宏汉霖等企业投入到TIGIT抗体的研发。
5.杨森first-in-class抗癌新药在华申报3项临床。杨森口服泛FGFR抑制剂erdafitinib的3项临床试验申请获国家药监局受理。Erdafitinib已于去年4月获FDA加速批准,用于治疗接受铂基化疗后疾病仍然进展并携带特定致敏性FGFR3或FGFR2基因突变的局部晚期或转移性膀胱癌成人患者。一项Ⅱ期临床结果显示,在化疗后疾病继续进展的携带特定FGFR3或FGFR2基因突变的患者中,erdafitinib达到32.2%的总缓解率,其中2.3%的患者达到完全缓解。患者平均缓解持续时间达到5.4个月。erdafitinib对抗PD-L1/PD-1疗法没有反应的患者也产生疗效。目前,一项评价erdafitinib在FGFR基因异常晚期尿路上皮癌患者中疗效及安全性的研究正在中国进行中。
6.天演药业完成D轮融资。天演药业完成6900万美元的D轮融资,所得款项将用于推进主要临床项目ADG106和ADG116的开发,以及前沿新技术的拓展。天演药业自主研发的ADG106是一种具有全新作用机制的全人源单克隆IgG4抗体,在美国和中国针对晚期或转移性实体瘤及血液肿瘤患者进行的I期临床中,已显示出优异的安全性。ADG116是一种拮抗型全人源单克隆IgG1抗体,与CTLA-4上独特的保守抗原表位结合。ADG116的新药临床申请已获FDA批准。
国际药讯
1.安斯泰来米卡芬净用药范围获扩大。FDA批准安斯泰来Mycamine(米卡芬净注射液)的补充新药申请,用于治疗小于4个月的婴儿,治疗无脑膜炎/眼部感染的念珠菌血症、急性传播的念珠菌病、念珠菌性腹膜炎和脓肿。在婴儿中,新生儿念珠菌病与20%的死亡率以及婴儿的高发病率显著相关。2005年,Mycamine被批准用于治疗成人念珠菌感染;2013年,Mycamine被批准用于4个月及以上的儿童患者。随着此次批准,Mycamine是美国获批的第一种专门用于4个月以下婴儿群体治疗侵袭性念珠菌病的抗真菌药物。
2.Epizyme首创EZH2抑制剂tazemetostat在美申报上市。Epizyme公司已向FDA提交了EZH2抑制剂tazemetostat的一份新药申请,寻求加速批准tazemetostat用于已接受过至少2种系统疗法、携带或不携带EZH2激活突变、复发或难治性滤泡性淋巴瘤(FL)患者。一项II期临床数据显示,在EZH2突变患者亚组和野生型EZH2患者亚组中,经IRC评估的tazemetostat治疗的总缓解率分别为69%、35%,中位缓解持续时间分别为11个月、13个月,中位无进展生存期分别为14个月、11个月,两组中位总生存期均未达到。该研究中,tazemetostat的安全性和耐受性良好。
3.Blueprint公司RET抑制剂肺癌关键性临床成功。Blueprint Medicines公司高选择性RET抑制剂pralsetinib(BLU-667)在治疗RET融合阳性非小细胞肺癌(NSCLC)的Ⅰ/Ⅱ期临床ARROW中获积极结果。在已接受过铂类化疗的患者亚组中,pralsetinib治疗组的客观缓解率(ORR)达到61%,95%的患者肿瘤缩小,14%的患者完全缓解(CR)。在初治患者亚组中,pralsetinib组的ORR达到73%,所有患者的肿瘤均有缩小,12%的患者获CR。详细数据将在未来的医学会议上公布。Blueprint已向FDA滚动递交其新药申请。预计将在今年第一季度完成递交。
4.Verastem Oncology公司与Chugai公司达成授权许可协议。Verastem Oncology公司与日本中外制药(Chugai)公司达成一项独家许可协议,Verastem获得Chugai开发的拟用于治疗携带KRAS突变实体瘤的RAF/MEK抑制剂CH5126766(CKI27)的全球开发和推广权益。目前,合作双方正在开展一项验证CH5126766联合defactinib治疗携带KRAS突变的LGSOC、NSCLC以及结直肠癌(CRC)患者的Ⅰ/Ⅱ期临床试验,该试验的详细数据将于今年上半年公布。根据协议,Verastem将负责CH5126766的开发和全球推广,并向Chugai公司支付300万美元的预付款,以及CH5126766在未来的销售额分成。
5.新一代精准疗法公司Black Diamond申请IPO。Black Diamond Therapeutics公司拟IPO募资近1亿美元。Black Diamond成立于2015年,是一家专注于开发新一代精准疗法的生物医药公司。该公司专有的别构基因突变药理技术平台(MAP)开发的选择性抑制剂具有同时抑制多种别构基因突变导致的癌症的潜力。目前,该公司的两款抑制剂分别靶向表皮生长因子受体(EGFR)和酪氨酸蛋白激酶ErbB-2(HER2)受体上出现的别构基因突变。其主要候选药物为口服小分子抑制剂BDTX-189的Ⅰ/Ⅱ期临床试验将在今年上半年启动。此外,该公司还在研究一种治疗胶质母细胞瘤患者的临床前候选药物。
医药热点
1.美国癌症死亡率出现历史上最大幅度下降。2020年美国癌症统计报告在期刊CA发布。报告显示,美国癌症死亡率出现了有史以来最大幅度的年度下降(2.2%);肺癌、乳腺癌、前列腺癌和结直肠癌死亡率稳步下降,肺癌尤其突出(男性肺癌死亡率的下降速度从2008-2013年间的每年3%提高到2013-2017年间的每年5%。女性同期下降幅度从2%提高到接近4%);创新疗法驱动黑色素瘤死亡率的大幅度下降(2013-2017年间黑色素瘤死亡率每年下降7%);癌症发病率总体趋于稳定,肝癌发病率上升(2007-2016年间每年上升幅度为2%-3%,慢性丙肝病毒感染在美国是导致肝癌的最大风险因素)。
2.北京春节期间启动卫生应急机制。北京市卫健委发布通知,春节期间,北京市将全面启动卫生应急机制。北京市卫健委要求,节日期间,如突发公卫事件或突发重大人员伤亡紧急医疗救援事件,相关单位要按照“早发现、早报告、早控制、早解决”的原则,及时、有效地开展先期处置,同时要立即向北京市卫健委报告,口头报告最迟不晚于接报后10分钟,书面报告不晚于接报后1小时,并及时跟进续报相关情况。
3.今年医师资格考试时间表明确。国家卫健委医师资格考试委员会发布公告,明确今年医师资格考试时间安排表。2020年全国的医师资格考试报名方式包括网上报名和现场审核两部分。网上报名时间为1月9日~21日24时,现场审核为2月4日~17日。今年继续开展医师资格考试临床执业医师、临床执业助理医师、中医类别具有规定学历中医专业执业医师和具有规定学历中医专业执业助理医师医学综合笔试“一年两试”试点。公告强调,2020年不组织中医类别中医专业(朝医方向)、中医类别傣医专业考试,继续开展中医类别哈萨克医专业考试试点。
股市资讯
【润都股份】1)公司的片剂,硬胶囊剂,原料药(坎地沙坦酯)通过药品GMP认证行政许可。2)公司技术中心被认定为2019年(第26批)“国家企业技术中心”,可按照国家相关规定享受支持科技创新税收优惠政策。
【凯普生物】公司发布2019年年度业绩预告。2019 年预计实现归母净利润14,032.00万元-15,059.00万元,同比增长23.00%- 32.00%。其中,实现扣非后归母净利润13,133.00万元-13,929.00万元,同比增长32.00%-40.00%。
【博济医药】公司与中国南昌中医药与科创城管委会共同签署了《项目进区合同》,双方拟在科创城打造以孵化器+高端共享中医药研发平台为核心的中医药产业平台,具体建设内容包括中医药研发公共服务平台、配套孵化器及成立专项投资基金等。
审评动向
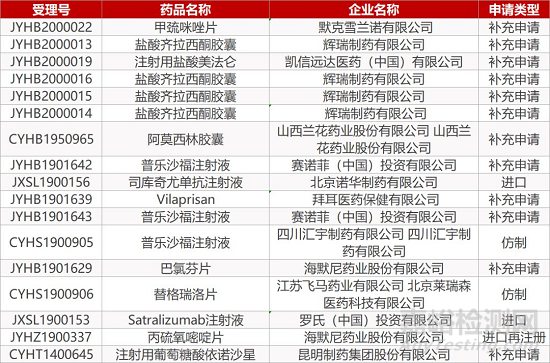
1. CDE最新受理情况(01月09日)
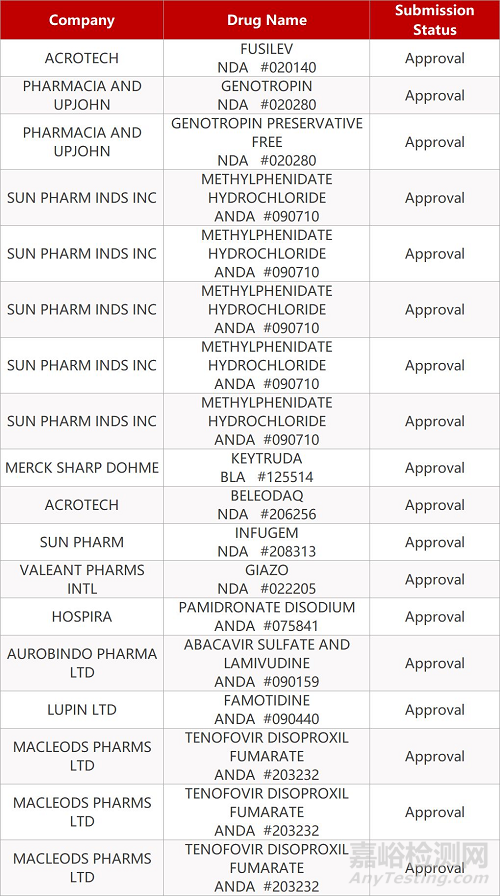
2. FDA最新获批情况(北美01月08日)

来源:药研发


