您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-11-12 19:39
蒋、煜,马玉楠,霍秀敏,马、磊
国家食品药品监督管理总药品审评中心
摘要
本文结合我国发布的《化学药品注射剂与塑料包装材料相容性研究技术指导原则》,对如何设计提取和迁移试验进行了阐述,重点对塑料包材中可能存在的目标化合物进行了分析。基于案例分析,讨论了如何依据安全性阈值(SCT)计算化合物的分析评价阈值(AET)以及基于AET数据选择灵敏度满足要求的分析方法,并对提取和迁移试验的实验设计和结果评估进行了分析。
正文
药品与包装容器的相容性涉及产品安全,一直为药品监管部门高度关注,也是药品研发及生产企业亟待了解并进行研究的内容。与口服制剂相比,注射液或注射用混悬液等制剂,由于给药后将直接接触人体组织或进入血液系统,被认为是风险程度最高的品种之一。
2008年1月10日,国家食品药品监督管理局发布了《关于发布化学药品注射剂和多组分生化药注射剂基本技术要求的通知》(国食药监注〔2008〕7号),对于化学药品注射剂,要求选取可作为注射剂包材/容器的材料,进行包材/容器相容性研究。2010年9月25日,国家局发布了《关于按CTD格式撰写化学药品注册申报资料有关事项的通知》(国食药监注〔2010〕387号),附件“化学药品CTD格式申报资料撰写要求”中2.3.P.2.5和3.2.P.2.5模块是制剂与包装相容性研究资料。上述要求均提醒药品研发及生产企业应重视药品与包装的相容性研究,并在申报产品时提交研究资料。
美国FDA于1999年发布了人用药品与生物制品包装用容器密封系统指导原则。欧盟EMA于2005年发布了直接接触塑料包装材料的指导原则,主要阐述了塑料包装材料的申报资料要求,对药品与塑料包装材料的相容性研究仅为一般性的描述,并无具体的试验方法及技术要求。但上述指导原则均仅对如何开展相容性研究提出了一般性指导建议,未提供具体的试验方法以及评价标准,难以指导国内企业开展研究。
我国食品药品监督管理局根据国内药物和包装材料相容性研究的现状,于2012年发布了《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》。我国开展此项研究的时间较短,研究基础相对薄弱,多数企业尚未深入了解和掌握如何开展相关研究工作。
1、分析包装材料成分
包装容器系统包括直接包装组件和次级包装组件。目前在注射剂中使用的塑料包装材料主要包括聚丙烯输液袋、瓶;多层共挤输液用膜制袋等。其中聚丙烯输液瓶包含瓶和组合盖两部分;输液袋通常含袋、接口、组合盖。由于塑料输液袋具有一定的透湿透气性,对于某些不稳定的产品,还可能在直接接触药品的包装基础上,使用具有一定阻隔性能的外袋,即所谓内外袋组合包装,某些产品在内外袋间还会使用吸氧剂,如氨基酸注射液等。
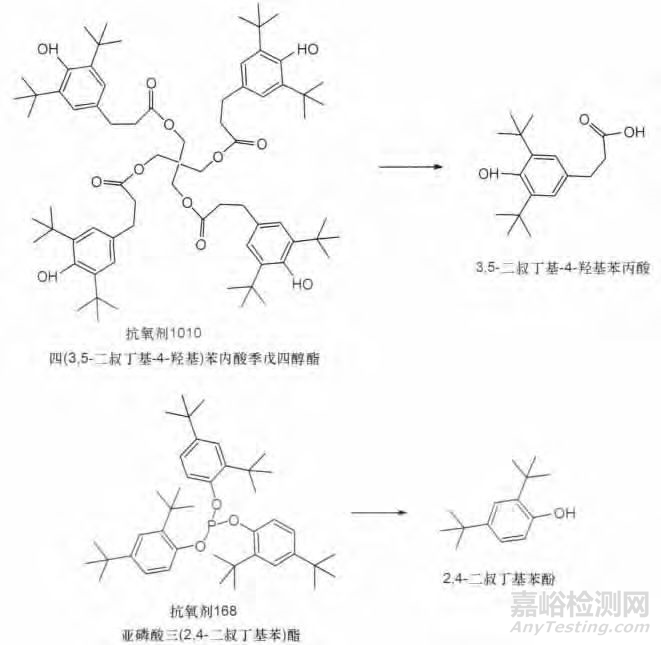
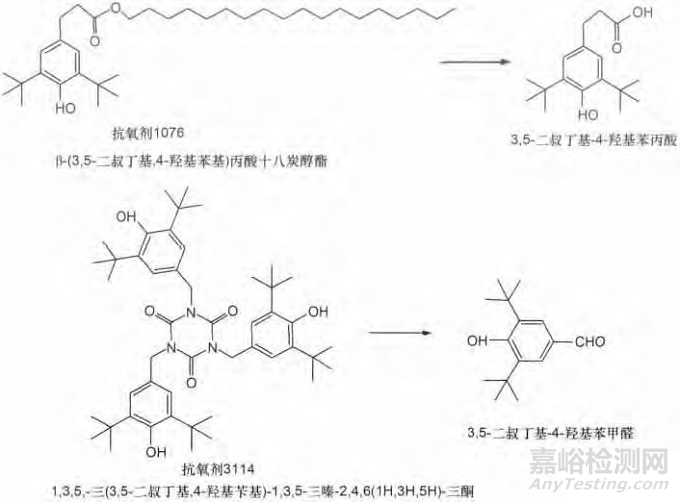
图1 抗氧剂1010,168,1076,3114及其潜在的降解产物
塑料包材中可能含有未完全反应的聚合物单体,聚合物以及添加剂也可能发生降解、结合和/或反应,如SEBS中可能混有未完全反应的苯乙烯单体。
上述添加剂及其反应物或降解物等均有可能在制剂生产和贮藏过程中迁移进入药物制剂中,在提取和迁移试验中,需将这些成份作为评估的对象。另外,塑料包装材料中油墨和黏合剂的成分,如异丙基苯、甲苯等也有可能渗透至制剂中。因此在提取和迁移试验之前,需首先明确塑料包装材料中含有哪些成份,并在此基础上进行评估和研究。
2、计算目标化合物分析评价阈值(AET)
基于安全性阈值(SCT),以及药物每日最大剂量、制剂包装情况(提取试验中使用容器的数量;与提取溶剂直接接触的表面积;制剂生产、运输、贮藏和使用过程中与药液直接接触部分的表面积等)计算每单个包装容器中,各浸出物或可提取物的最大允许的实际浓度,计算分析评价阈值(analytical evaluation threshold ,AET)。目前,对于吸入制剂包材浸出物,推荐的SCT值为0.15μg·D-1,对于注射制剂,尚未有正式的SCT 值发布,根据与PQRI专家的讨论信息,目前暂时建议采用1.5μgd-1的推荐值(该信息可能将根据ICH 等官方机构最终发布的权威信息进行修订)。
对于浓度水平达到或超过AET值的可提取物和/或浸出物,需要对其进行鉴定,以及安全性评估。可提取物和迁移物在注射液中多为痕量水平,分析方法的灵敏度必须满足AET 值浓度水平的测定需要。
通常情况下,挥发或半挥发有机物可选择气相色谱-质谱(GC-MS)法;半挥发及不挥发有机物可选择液相色谱-质谱(LC-MS)法;无机或有机阳离子和阴离子可选择有机酸、碱分析离子色谱(IC)法;无机元素类提取物(如微量元素和重金属等)可选择电感耦合等离子体原子发射光谱法(ICP-AES)、电感耦合等离子体发射光谱-质谱法(ICP-MS)。例如油墨中的甲苯可采用GC法进行测定。
对于某些大容量注射液,迁移物浓度较低难以使用常规方法进行检测,应采用适当方式对样品进行处理,如浓缩或者对供试溶液进行固相萃取以使其浓度满足测定方法的灵敏度。
提取试验主要进行方法专属性、灵敏度等简单的方法学验证;迁移试验的方法学验证内容包括:准确度、精密度(重复性、中间精密度和重现性)、专属性、检测限、定量限,线性及范围和耐用性等。
3、试验设计
3.1、提取试验
提取试验的目的是预测塑料包材中可能的迁出物质。在对塑料进行测试时,通常会选择各种性质的提取溶剂,如乙醇、异丙醇等有机溶剂,不同PH 值、极性及离子强度的水溶液。不同性质的提取溶剂获得的可提取物不同,亲脂性溶剂可提取出更多的亲脂性化合物。
在对制剂进行相容性研究时,可选择与制剂具有相同或相似理化性质的提取溶剂。如果药液性质与塑料测试选择的提取溶剂性质相似,也可采用其试验结果对可提取物进行预测。通常选择的提取溶剂包括注射用水、0.9%氯化钠注射液、PH、3.5缓冲液、PH、8.0缓冲液、10%或15%乙醇等。
为了尽可能多的获取可提取物信息,通常会选择比药物制剂灭菌、贮藏条件等更为剧烈的提取条件。例如:某注射剂采用121℃,15miN作为灭菌条件,在进行提取试验时,可选择121℃,60miN的提取条件。应该注意到,塑料材料可能在高温下发生更为剧烈和复杂的降解,因此通常选择在灭菌温度下,延长提取试验,以保证从包装材料中提取出尽可能多的可提取物,但又不致使添加物过度降解以致干扰试验。
3.2、迁移试验
迁移试验是考察产品在正常生产和贮藏条件下,产生浸出物的实际情况。因此在选择试验条件时,需要充分考虑药品在生产、贮存、运输及使用过程中可能面临的最极端条件。通常选择加速稳定性试验以及长期稳定性试验的条件。
如果药物存在不同的规格或浓度,药液与包材的接触面积存在差异,为了测定添加物质可能发生迁移的最大程度,通常可采用药液与包材最大接触面积,并采用最高浓度和最低浓度药液进行试验。在试验过程中,需要合理放置药品以使其与包装容器充分接触。例如,将塑料袋印字一面向下放置,保证最大限度地模拟标签或油墨成分的迁移情况。
在进行提取试验时,应尽量避免可能干扰试验结果的因素。例如,选择硼硅玻璃瓶或聚四氟乙烯瓶,以及聚四氟乙烯或聚丙烯塞,或其他惰性容器进行平行对照试验,但不宜选择橡胶塞作为密封件。在试验出现异常情况时,可考虑进行空白干扰试验,以排除供试品本底干扰,避免出现假阳性结果。
4、结果评估
4.1、确定目标化合物的安全性阈值(PDE/QT)
可基于安全性数据库,如致癌性数据库(CPDB)、美国环境保护署(EPA)数据库、美国毒物和疾病管理中心(ATSDR)数据库等[6]对塑料包装材料中可能存在的化学物质进行评估。
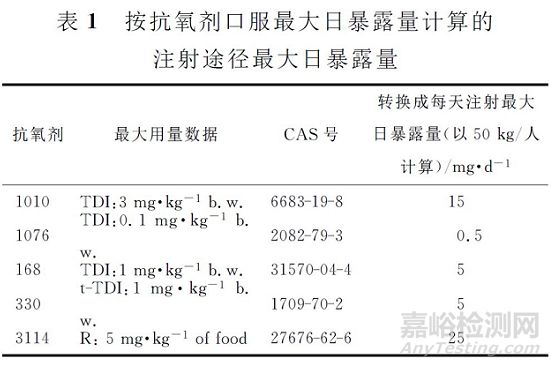
对于PDE数据未知的物质,如果可以获得动物的无毒性反应剂量(NOEL)以及最低无毒性反应剂量(LOEL)数据,可参考ICHQ3C(杂质:残留溶剂指导原则),计算得到口服给药途径的PDE数据。
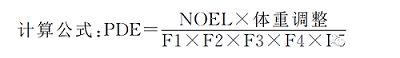

可以看出,不同数据来源,不同计算方式获得的PDE值存在差异,建议在获取尽可能多的毒性数据基础上进行综合评估,对最终确定的PDE值的合理性进行分析和评估,通常推荐使用最为敏感的啮齿动物数据进行计算。对于未获得毒性数据的化合物,可参考结构类似物推测其PDE值。如3,5.3-二叔丁基-4-羟基苯丙酸为抗氧剂1010和抗氧剂1076潜在的降解产物,潜在致癌性数据库等未收载该物质相关的毒性数据。根据结构类似性,可采用两个前体中较低的PDE值0.3mg·D-1进行安全性评估。
4.2、结果判定
建议参考《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》[2]进行试验结果评估。
对于可获取PDE值的目标化合物,如果可提取物的含量低于PDE,则一般认为由该可提取物导致的安全性风险小,在后续的迁移试验可省略对该成分的研究,但仍应该在后续的迁移试验中对该成分可能产生的降解产物或者相关产物等进行考察[7]。如果浸出物含量低于PDE时,可认为浸出物的量不会改变药品的有效性及安全性,对患者的安全性风险小。如果浸出物的含量高于PDE时,则建议更换包装材料。
对于PDE数据未知的物质,推荐采用两种阈值来进行结果判定———界定阈值(QT)及安全性阈值(SCT)。对于吸入制剂,通常需对高于QT(5μg·D-1)的化合物进行安全性评估,低于QT的则只需要定性,确定不含“警惕性结构”后,不需要进一步进行安全性评估;低于SCT(0.15μg·d-1)的化合物致癌毒性和非致癌毒性的担忧通常均可忽略不计。对于注射途径,可以参考上述评估思路,但目前还没有官方发布的权威数据。文献详细阐述了SCT,QT值的原理、来源以及适用范围。
应当注意的是,对于某些具有特别高致癌性的物质,如黄曲霉毒素结构类似物、N-亚硝基,以及氧化偶氮基的化合物,不宜采用上述SCT值,而应采用更为严格的标准。
5、结语
本文对《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》中提取迁移试验方法设计进行了解读,初步分析了塑料包装材料中可能存在的组分,对PDE,QT,SCT等安全性阈值在提取迁移试验中所发挥的作用进行了阐述,对提取迁移试验的常规方法设计和结果判断进行了解析。我国对药品与包材相容性研究开展时间较短,对其的认识和理解在不断加深。值得注意的是,与此前发布的指导原则相比,新的认识对AET的计算方法有一定的修订,并引入了QT的概念。以上信息供药品研发和生产企业在进行药品与包装容器系统进行相容性研究时参考。

来源:中国新药


