您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-08-11 12:00
一、为什么 ISO 7405:2025 对牙科行业至关重要?
1.1 牙科医疗器械的特殊性与风险
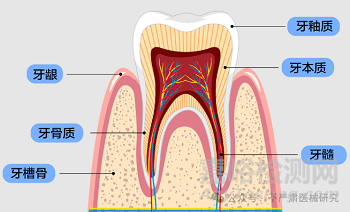
口腔组织(牙髓、牙龈、牙槽骨等)具有高敏感性,长期接触牙科材料可能引发毒性反应、炎症或过敏。例如,树脂材料释放的单体可能刺激牙髓,种植体表面涂层脱落可能导致骨吸收。因此,生物相容性评价是保障临床安全的核心环节。
1.2 标准迭代
ISO 7405 是全球公认的牙科医疗器械生物相容性评价准则,2025 年第四版在 2018 版基础上进行技术修订,进一步提升评价的科学性和精准性,为企业研发、监管审核和临床应用提供统一标准。
1.3 标准解读
帮助牙科材料企业、检测机构、临床医生快速掌握标准核心内容,明确合规要求,提前布局测试与研发调整。
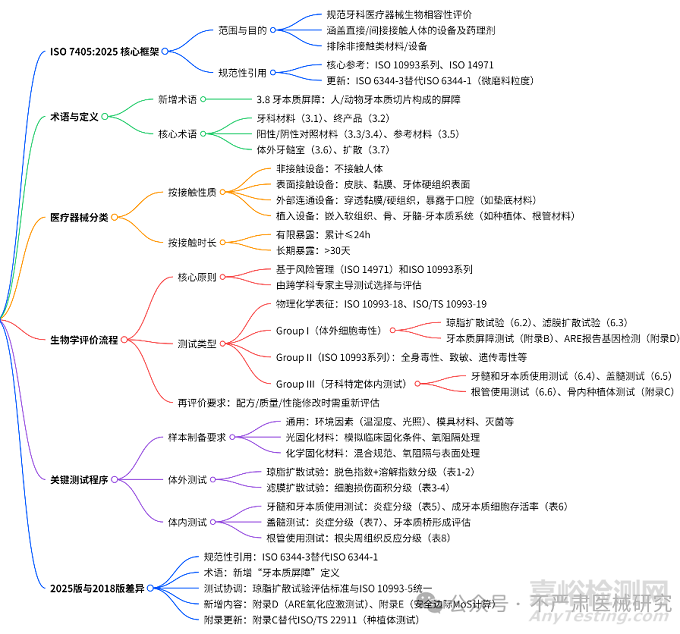
二、标准范围、目的与规范性引用
2.1 适用范围
纳入对象:直接或间接接触患者身体的牙科医疗器械(如种植体、充填材料、根管封闭剂),包括设备中整合的药理剂(如含生长因子的骨替代材料)。
排除对象:不接触人体的设备(如牙科手机外壳、照明设备)。
2.2 核心目的
规范牙科医疗器械生物效应的评价方法,通过科学测试识别潜在风险,确保材料在临床使用中对口腔组织的兼容性。
2.3 规范性引用
核心标准:ISO 10993 系列(生物评价通用要求)、ISO 14971(风险管理)、ISO 16443(牙种植体术语)。
关键更新:用 ISO 6344-3(微磨料粒度分布)替代 2018 版的 ISO 6344-1,统一微磨料(P240 至 P5000)测试标准。
三、关键术语解析
3.1 新增核心术语
牙本质屏障(3.8):由人或动物牙本质切片构成的屏障,用于模拟牙髓 - 牙本质界面的物质扩散过程,是体外牙髓毒性测试的核心模型。
3.2 基础术语清单
术语
定义要点
作用
牙科材料(3.1)
专为牙科实践配制的物质或混合物,包含材料成分
明确评价对象范围
终产品(3.2)
含生产流程(包装、灭菌)及使用前处理(混合、预处理)的成品
确保测试对象与临床使用一致
阳性对照材料(3.3)
已知会引发阳性反应的材料(如含 ZDEC 的聚氨酯),验证测试系统有效性
确保测试结果可靠
阴性对照材料(3.4)
无毒性反应的材料(如高密度聚乙烯),反映细胞背景反应
排除系统干扰
体外牙髓室(3.6)
夹持牙本质切片的装置,模拟牙髓环境中物质通过牙本质的扩散
体外测试的核心装置
四、医疗器械分类:如何确定测试边界?
4.1 按接触性质分类
类别
定义与示例
测试重点
非接触设备
不接触人体(如
无需生物相容性测试
表面接触设备
接触皮肤、黏膜或牙体硬组织表面(如牙冠、正畸托槽)
刺激性、致敏性
外部
穿透黏膜 / 硬组织但暴露于口腔(如垫底材料、临时修复体)
短期毒性、微渗漏
植入设备
嵌入软组织、骨或牙髓 - 牙本质系统(如种植体、根管充填材料)
长期毒性、组织整合性
4.2 按接触时长分类
有限暴露:累计接触≤24 小时(如临时粘固剂)。
长期暴露:累计接触 > 30 天(如永久种植体、义齿基托)。
4.3 分类原则
多类别适用时,按最严格要求测试(如兼具表面接触和植入特性的材料,按植入设备要求测试)。
多次暴露需考虑累积效应(如反复使用的修复材料需评估残留物质蓄积风险)。
五、生物学评价流程
5.1 核心原则
基于风险管理框架(ISO 14971),由跨学科专家(化学、生物学、牙科临床)主导,优先利用已有数据(如材料成分、历史临床数据),数据不足时开展补充测试。
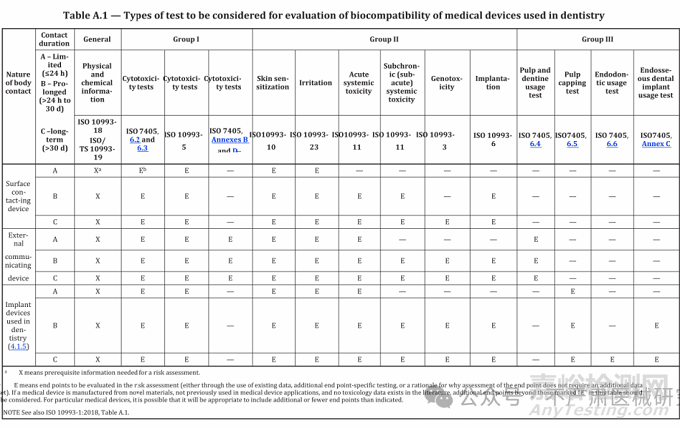
5.2 测试类型
测试类别
核心测试项目
适用场景
Group I(体外)
琼脂扩散试验、滤膜扩散试验、牙本质屏障细胞毒性测试、ARE 氧化应激测试
初步筛选材料毒性
Group II(通用)
全身毒性、皮肤致敏、遗传毒性、植入后局部效应(按 ISO 10993 系列)
评估系统风险及长期安全性
Group III(专项)
牙髓使用测试、盖髓测试、根管使用测试、骨内种植体测试
模拟临床场景的特异性评
5.3 再评价触发条件
当设备配方、生产工艺或性能规格修改时,需重新评估生物相容性(参考 ISO 10993-1:2018 中 B.4.5.1 的具体要求)。
六、核心测试程序详解:体外到体内的关键方法
6.1 样本制备要求
通用条件:控制温度(37±2℃)、湿度(90±10%)、光照(光敏材料需避光),模具选用聚乙烯或 PTFE(避免干扰材料固化)。
光固化材料:按制造商要求固化(记录 irradiance、时间),两端覆盖聚酯膜防止氧抑制层影响。
化学固化材料:严格按比例混合,固化期间密封模具避免氧暴露,必要时用 P2000 砂纸打磨表面。
6.2 体外细胞毒性测试
琼脂扩散试验:
原理:材料释放物通过琼脂扩散后,观察细胞脱色区和形态变化。
分级:通过 “脱色指数”(0-4 级)和 “溶解指数”(0-4 级)评估毒性(如脱色区 > 1cm 为严重毒性)。
滤膜扩散试验:
原理:材料释放物通过纤维素滤膜后,检测细胞酶活性降低区域。
分级:按脱色面积评估(<20mm² 为轻度,>40mm² 为严重)。
6.3 牙科专标体内测试
牙髓和牙本质使用测试:
模型:动物牙制备窝洞(剩余牙本质厚度 0.5-1mm),填充测试材料。
评估:5/25/70 天后观察牙髓炎症(0-4 级)及成牙本质细胞存活率。
盖髓测试:
模型:牙髓暴露后覆盖测试材料,观察牙本质桥形成及炎症控制效果。
根管使用测试:
模型:动物牙根管预备后充填材料,28/90 天后评估根尖周组织炎症及骨反应。
七、2025 版 vs2018 版:核心差异与升级亮点
差异类别
2025 版变化
影响意义
规范性引用
用 ISO 6344-3 替代 ISO 6344-1
统一微磨料测试标准
术语更新
新增 “牙本质屏障” 定义
推动牙本质相关测试标准化
测试协调
琼脂扩散试验评估标准与 ISO 10993-5 统一
减少跨标准验证成本
新增附录
附录 D(ARE 氧化应激测试):评估材料对细胞抗氧化系统的干扰
补充毒性机制研究维度
新增附录
附录 E(安全边际 MoS 计算):通过 “耐受摄入量 / 暴露剂量” 量化化学风险
强化化学物质管控
附录整合
附录 C 替代 ISO/TS 22911,规范骨内种植体测试
简化种植体测试流程
八、企业如何适应新规范?
8.1 测试要求升级
需新增 ARE 氧化应激测试(针对树脂、粘接剂等易产生活性氧的材料)。
强化化学表征:通过 MoS 计算管控残留有害物质(如单体、重金属),需开展 exhaustive extraction( exhaustive extraction)和 exaggerated extraction( exaggerated extraction)。
8.2 方法标准化
实验室需更新 SOP,统一牙本质屏障测试的样本制备(如牙本质切片厚度 500±50μm)、琼脂扩散试验的评估标准等,确保数据可比。
8.3 动物福利优化
鼓励 “一动物多测试”(如同时开展牙髓使用测试和盖髓测试),减少动物数量。
推动体外替代模型(如 3D 牙髓细胞培养)研发,降低对动物测试的依赖。
8.4 合规建议
优先利用历史数据和 MoS 计算减少不必要的动物测试。
针对高风险材料(如长期植入体)提前开展新增测试项目验证,确保上市合规。
九、总结
ISO 7405:2025 通过整合新测试方法、强化化学风险量化,为牙科医疗器械生物相容性评价提供了更科学的框架。企业需将标准要求融入产品研发全流程,在合规基础上推动材料创新,最终实现 “安全与性能并重” 的口腔医疗目标。
附录:关键图表与参考资料
图 1:ISO 7405:2025 标准框架示意图
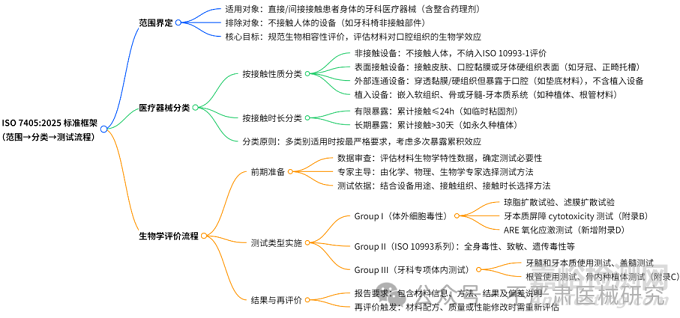
图 2:牙科医疗器械分类
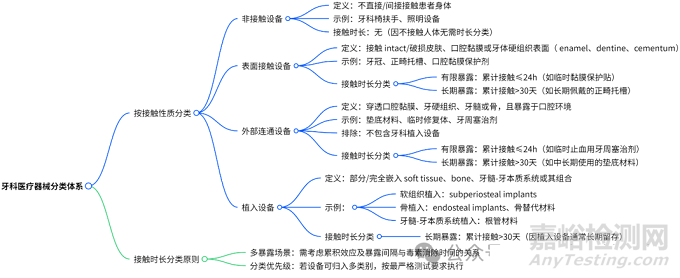
图 3:2025 版内容与 2018 版核心差异对比表
页脚声明:本文基于 ISO 7405:2025 标准解读,仅供学习参考,具体合规以标准原文为准。

来源:不严肃医械研究


