您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-05-23 15:06
1、概述
胶囊剂是仅次于片剂的第二大口服剂型。早在1834年,在法国就出现了明胶胶囊的专利。随后,明胶胶囊的应用被传播到世界其他地区。到了1846年,也是在法国,有人发明了两片式的硬胶囊。与之相应的胶囊生产设备也在不断的发展。同时生产囊壳和囊帽的机器大约在1931年出现,那时的设备生产原理已经和现代的生产设备基本一致了。经过多年的发展,胶囊在锁合工艺、印花、自动化生产机械适应性、药物控制释放等方面不断改进,不断满足越来越多的制剂需求。
胶囊剂的基本想法是将各种内容物填充入特定的胶囊中。胶囊内容物可以是粉末、粒子、微丸、微片、微胶囊、甚至是流体或半流体。随着制剂技术的发展,胶囊本身也随之进一步发展为硬胶囊和软胶囊,临床应用也从普通口服制剂发展控制释放制剂,也开始在吸入制剂、栓剂、诊断试剂等其他特殊制剂方面得到应用。但目前应用最多的仍然是两片式的硬胶囊制剂,填充的内容物最常见的则是各种粉末或者粒子。在本文中,未经特殊说明,本文中的胶囊即指这种硬胶囊。
相对于片剂,胶囊剂有其独特的优势和劣势(见表1)。总体而言,胶囊剂对输入物料的属性的要求更为简单,因此所需的开发过程更短,这使其在新药制剂的开发过程中有很大的吸引力,可以有力地保障项目的快速推进。但是其预设的胶囊壳的尺寸和制备材质却对制剂处方工艺设计施加了众多限制。这使得胶囊剂的研发者需要更为全面的了解胶囊剂开发过程中所面临的各种问题和抉择,以尽可能的避免可能出现的处方和工艺问题。
表1. 胶囊剂的优缺点
|
优点 |
缺点 |
|
1.表面光滑、椭圆形的囊壳更利于吞咽; 2.可以完全隔离药物和口腔的接触,有利于掩味; 3.可以对胶囊壳灵活修饰(颜色、图案、印字等),以满足各种商业化、安全性和顺应性的需求; 4. 预设的体积可以很好地匹配各类填充和包装设备; 5.填充内容物多样化,填充过程对内容物影响较小; 6. 内容物的物料参数比片剂要求简单; 7.临床试验中实现编盲的方法简单。 |
1.胶囊壳的体积固定,且不连续,可选数量有限; 2.胶囊壳可选材质有限,可能引发一些与材质本身特性相关的问题,例如与原料或者其他辅料的相容性问题; 3.胶囊填充物相对于片剂基本无压缩,体积更大,药物剂量受限; 4. 商业化胶囊填充设备复杂,拆装及清洗较片剂更为复杂; 5. 剂量无法进一步细分。 |
2、胶囊结构和标准尺寸
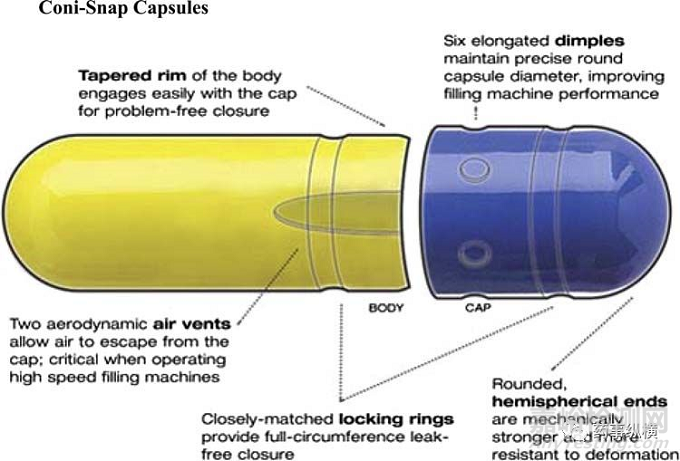
图1. 明胶胶囊壳的结构示意图
最为常见的硬胶囊壳是两片式的结构,分为囊体和囊帽(如图1)。胶囊壳独特设计使得其可以实现预锁、锁合、排气以及调整转向和平行排列等功能。胶囊在使用前,一般处于预锁状态,在胶囊机填充机的配合下,可以快速实现囊帽囊体分离,内容物填充,囊帽囊体锁死的循环。
商业化的胶囊壳的尺寸已经标准化,从5号到000号,体积从0.13ml到1.37ml逐渐增大。对于不同型号的胶囊壳而言,其体积大小往往代表了其最大的填充体积,是在进行胶囊剂处方设计,选择胶囊壳型号时需要考虑的重要因素。但是在实际的胶囊填充生产中,内容物的填充量主要由设备确定。当然,胶囊填充能否顺利,选择合适型号的胶囊壳是基础。不同的填充原理的设备能够填充的物料体积也不尽相同。
例如计量盘填充原理的设备,物料会形成圆柱,然后转移进胶囊囊体中,胶囊的囊体中存在些许死体积;许多半自动的填充设备,则是已用物料自身的重力填充胶囊,能够填充的体积会比“计量盘”填充的体积略大。通过填充内容物的堆密度和振实密度对评判胶囊壳大小是否合适是有帮助的。但是实际的制剂处方开发早期,不可能制备各种处方的中间体并用以测定堆密度和振实密度。
利用各个物料的真实密度,并采用预估的空隙率值,可以初步设计几个原型处方。在原型处方的基础上结合填充设计进行试错及处方调整。显然,填充内容物的体积超过胶囊的体积,填充过程可能无法顺利进行;填充内容物体积过少,一方面降低胶囊壳的利用率,增大制剂体积,同时也可能增大胶囊的制剂特性的变异性。
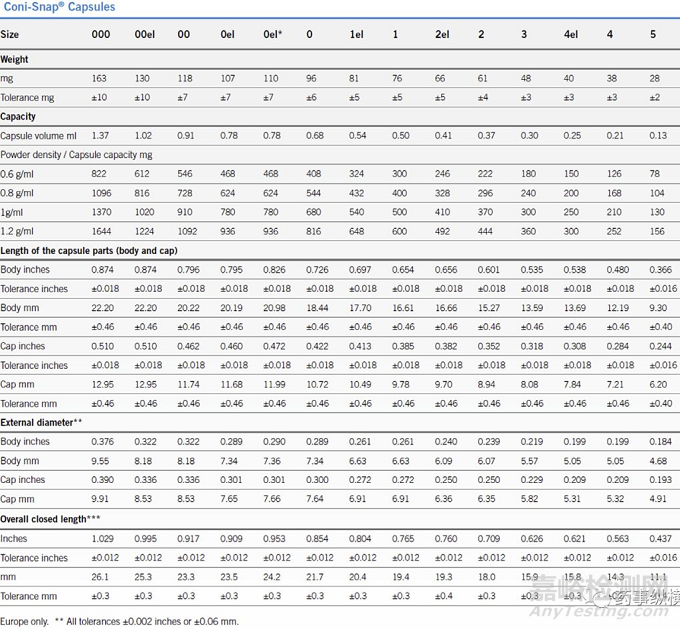
图2. 明胶胶囊壳的标准尺寸
胶囊壳型号选择的另一个考虑是病人的顺应性,显然,过大的胶囊将不利于病人的吞咽。2015年,FDA发布了与制剂尺寸和形态的相关的指导原则(《Size, Shape, and Other Physical Attributes of Generic Tablets and Capsules》),尽管该指导原则主要是针对仿制药研发,但在新药制剂开发过程中的形状考虑也有重要的借鉴意义。针对胶囊剂,该原则也明确的指出,胶囊的体积不应该超过00号的尺寸。对于片剂而言,当直径超过8mm时,与吞咽相关的投诉增加。
在临床试验过程中,采用大尺寸的制剂可能是允许的,因为在严密的监控和足够的安全保障下,因吞咽发生安全性问题的几率会大大降低。而对于志在商业化的制剂,更好的选择则是尽可能避免吞咽问题,以提高病人的顺应性,增加市场竞争力。笔者认为,即使胶囊剂比片剂更容易吞咽,也应当在制剂设计中尽量遵循该限度(直径不超过8mm),即尽量使用0号及体积更小的胶囊。
3、胶囊的材质
胶囊壳主要由基质材料构成,根据需要添加着色剂、遮光剂。对于已经商业化的普通空心胶囊而言,最为常见的基质材料便是明胶和羟丙甲纤维素(HPMC)
3.1 明胶空心胶囊
明胶空心胶囊是可能是最早使用的胶囊壳,也是目前使用最为广泛的胶囊壳。动物组织在适当条件下经过脱油脂、脱矿物质等一系列工艺获得明胶。明胶在适当的稳定下溶于水形成溶液,特制的模具浸入热的明胶溶液中,溶液遇冷发生凝胶化成膜,再经过干燥抛光等后处理便得到了空心胶囊。凝胶中结晶区和非结晶区交错形成的交联结构,使得其具有优良的机械性能,刚性来源于结晶区以及不同肽链间的相互作用,韧性则来源于非晶区和水分的塑化作用。
明胶具有优良的成膜性能和机械性能,在人体温度下和生物介质中拥有良好的溶解行为,这奠定了明胶胶囊壳作为囊壳霸主的地位。另一方面,明胶空心胶囊的广泛使用必然促进其制备技术的不断发展,发展到如今,制药公司可以轻松地在市场上从不同的供应商获取优异的明胶空心胶囊。它们不仅价格低廉,而且各种性能(如重量、尺寸和崩解等)优异且变异性很小,进一步促进了硬胶囊剂的发展。但是经过多年的应用,明胶空心胶囊也逐渐展现出其不足之处。
首先,明胶是动物来源的材料,因此在面对素食病人,将会遇到一些麻烦。同时,近些年出现的“疯牛病”问题,也让明胶胶囊遭受风险。确保原辅料无BSE/TSE风险是十分必要的,审评机构也要求在相关的申报中对动物来源的辅料提供相应的申明。
从化学本质上将,明胶是由肽链构成的,不同的氨基酸残基仍然存在反应活性,例如精氨酸残留的氨基或带有额外羧基的谷氨酸,凝胶体系中的水分可能进一步提高了它们的反应活性。不同的来源的明胶肽链的构成不同,使得这一问题更加复杂。其化学特征也使其极容易和醛类、还原性糖、金属离子、表面活性剂等化学化学反应。明胶胶囊制剂最为常见的交联问题便是与其明胶的组成密不可分的。关于明胶胶囊的交联问题的解决,请读者参考药物纵横发表的梅希撰写的文章《明胶胶囊交联问题的研究思路》。此外,肽链的聚电解质结构,使其容易和带电高分子材料发生相互作用,也可能在某些性质上呈现pH敏感性。
明胶空心胶囊的另一个关键组分是水,其水含量一般在13%~16%之间,这些水分对维持明胶的弹性和韧性至关重要。如果水分过低(<10%),明胶胶囊变脆,在胶囊机进行填充工作过程中,容易发生胶囊碎裂而影响成品质量;在运输和使用过程中也可能引发问题。另一方面,由于明胶较强的亲水性,在湿度较高时(>70%RH)吸收的水分会迅速增加,水含量过高时,胶囊会变软发黏,甚至发生相互粘连或与包材的粘连。
因此胶囊壳必须注意储存条件。一般而言,如果湿度控制在35~65%RH温度控制在15~25℃,应该可以获得5年的货架期。由于明胶空心胶囊壳必须维持合适的水分,胶囊剂在进行处方设计时着重考虑这一点。一方面,对水敏感的API可能存在稳定性风险;另一方面,吸水性过强的辅料可能从胶囊壳中夺取水分,使胶囊壳在储存期间脆性增加。此外,明胶可以支持微生物生长,笔者曾经遇到过高湿条件下,明胶胶囊长菌的情况,但是如果明胶的水分控制在恰当的范围(13~16%),微生物生长的风险其实很低。
除了明胶和水分之外,空心胶囊中还有一些添加剂成分,可以根据需要添加。着色剂,用于调节胶囊壳的颜色,多为水溶性的合成染料;遮光剂,例如二氧化钛、氧化铁;有时,胶囊壳中也会添加工艺助剂,例如十二烷基硫酸钠。在选择胶囊壳时,需要清楚的了解胶囊的成分,可能实现提前规避相关问题。
3.2 HPMC空心胶囊
HPMC空心胶囊目前是明胶空心胶囊的最佳替代品,已经在许多上市产品中得到应用,越来越多的IND也开始采用这种胶囊壳,以尽可能避免明胶胶囊带来的稳定性问题。其实早在上世纪50年代,来自礼来的科学家已经获得了以甲基纤维素为主要成分的硬胶囊制剂的专利,以期作为明胶空心胶囊的替代品。随后在1989年,出现了第一个以HPMC为主要成分的空心胶囊,商品名是Vegicaps。基于胶囊的使用状况和市场需求,HPMC空心胶囊的制造技术也在不断的进步,出现了更多的商业化HPMC空心胶囊,例如Quali-V、Embo Caps-Vg、Vcaps Plus等,但是HPMC空心胶囊的供应商相对较少。
HPMC是植物纤维素的醚,纤维素的糖单元中的部分羟基被羟丙基取代(约4~12%),部分羟基被甲氧基取代(19~30%)。这种取代的结果破坏了纤维素糖链之间羟基的强烈相互作用,同时抑制了其结晶性,使之更为容易地在水中形成溶液,也更为容易的形成弹性和韧性较好的膜,从而能够通过与明胶空心胶囊生产类似的工艺获得空心胶囊。但是HMPC的水溶液性质与明胶溶液的性质不同,HMPC溶液需要在高温下才能形成凝胶,因此需要模具维持更高的温度以维持HPMC的凝胶态直至干燥成型,这较大地增加了工艺难度;
此外,HPMC形成的膜相对明胶膜强度更低,一般通过增加HPMC膜的厚度,以使其能够顺利从模具上剥离。在早期的HPMC空心胶囊生产中,通过在HPMC溶液中加入凝胶化助剂降低凝胶化温度。采用这种方法生产的空心胶囊的代表是QualiV和Vcaps。这些胶囊在崩解、重量差异、以及漏粉等问题上表现差强人意。因此,胶囊制造商进一步改进工艺,不再需要加入凝胶化助剂,获得了最新一代的HPMC空心胶囊,商业化空心胶囊的代表则是Vcaps Plus。Vcaps Plus的制造商Capsugel系统地比较了这两种工艺下生产的胶囊(Vcaps Plus vs. Quali-V和Vcaps),前者在外观、机械性能和崩解方面都展现出更为优良的性能。
HPMC空心胶囊是植物来源的,这为素食患者提供较好地解决方案,同时也避免了疯牛病问题。从化学本质上看,HPMC是纤维素的醚,糖链上残留的基团只是羟基,与大多数药物和辅料不存在相容性问题,能够供足够的稳定性。虽然也可能存在氧化老化等问题,但是相对于明胶而言,稳定性已经大大提升。同时,从理论上看,这种空心胶囊也不存在交联问题。
对于维持明胶胶囊机械性能十分关键的水分,对于HPMC胶囊来说也显得不是那么关键。HPMC空心胶囊的水分一般为4~7%,仅有明胶空心胶囊的三分之一左右。有研究者对比了明胶空心胶囊和HPMC空心胶囊(Vcaps Plus)的动态吸湿曲线(见图3),其中可见HMPC空心胶囊的吸湿性要远远低于明胶胶囊。掌握这些数据对把握胶囊的存储条件和处方设计有较好的帮助。也有研究表明湿气对明胶胶囊壳的渗透性要大于HPMC空心胶囊,显然,这与前者的水含量更高有关。
更为重要的一点是,水分的减少对HPMC空心胶囊的机械强度影响也不是十分显著,根据笔者的经验,即使HPMC空心胶囊的水分低至2%,其仍然能够维持较好的韧性,不会出现类似明胶胶囊变脆的问题,这使得HPMC胶囊制剂可以在极低湿度的条件下储存(包材中加入干燥剂、或者在某些湿度很低的地区销售)。HPMC胶囊的这些特征使其成为湿气敏感药物开发优良选择。
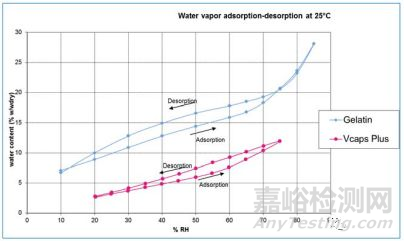
图3. 明胶空心胶囊和HPMC空心胶囊(Vcaps Plus)的动态吸湿曲线
在短期应对高温的稳定性方面,HPMC空心胶囊的表现也更为优异。有研究表明Vcaps Plus在高达60~90℃的条件下储存24h,虽然外观有所变化,崩解和溶出以及机械性能基本没有变化。
在某些情况下,使用HPMC空心胶囊还有一些意外之喜。HPMC作为药用辅料已经在固体制剂的开发中广泛应用,其作为结晶抑制剂可以维持药物在胃肠道中的过饱和状态,从而提高药物的生物利用度。以HPMC作为胶囊壳,也能提供了这种抑制结晶和沉淀的功能性。有研究表明,Vcaps Plus胶囊能够提高弱碱性药物和无定型药物(固体分散体)的生物利用度。
相对于明胶胶囊的漫长应用历史,HPMC胶囊的应用时日尚早,也远未达到能够替代明胶空心胶囊的地步。这与目前商业化的HMPC空心胶囊展现出的一些缺点相关。
首先是成本问题。上文提到HPMC溶液的凝胶化温度相对于明胶溶液更高,生产设备和工艺要求更高,成本也相应升高。其次,HPMC的成膜性能比明胶的更差,HPMC空心胶囊生产中,膜的厚度更难精确控制,因此重量的变异性仍然比明胶空心胶囊高。这种重量的高变异性可能给胶囊填充时的重量监控带来麻烦,尤其是填充量较小时,囊壳质量的变异性对最终成品的质量的变异性增加,即使填充机的填充量精准,仍然存在部分胶囊的质量超出限度。这种膜厚度控制的变异性,也会给胶囊壳的锁合带来麻烦。
例如Quali-V容易出现内容物的泄露,这是由于囊体和囊帽之间的缝隙过大,改进后的Vcaps Plus缝隙大大较小,以至于较难出现漏粉问题,但是其缝隙仍然略大于明胶胶囊。此外,HPMC膜的强度低于明胶膜,即使增加膜的厚度,HPMC空心胶囊的强度仍然低于明胶空心胶囊,在受到外力冲击时,弹性比明胶空心胶囊偏小。这种机械强度上的差异直接导致HPMC胶囊在上机生产的生产中,出现胶囊次品的概率更高,最容易出现问题的地方是锁合工序。
对于新药研发来说,上述这些问题其实都还可以接受,毕竟快速至上市才是新药研发的关键。HMPC空心胶囊最大的问题可能是体外溶出试验中胶囊开口破裂的时间较长引起溶出迟滞以及开口破裂时间的较大变异性。
对于明胶胶囊,在体外的溶出或崩解试验中,在常用的试验介质中,一般2~3min即可发生胶囊壳破裂,迅速地释放胶囊内容物。胶囊壳的崩解时间变异性一般较小,在不同介质中的胶囊壳的崩解或破裂时间差距也不大。更为重要的是,由于其崩解所需时间较短,对溶出曲线的影响较小。虽然不同供应商的产品可能处方工艺略有不同,但其崩解时间的差异也不会太大。制剂或处方的发生变更时,按照相关法规要求,能够容易地进行不同介质中溶出曲线的比较。对于变更频繁的创新药开发而言,这种比较成功往往意味着研发的加速和费用的降低。
与明胶胶囊的稳定崩解不同,HPMC胶囊在溶出试验中开口破裂时间延长,且呈现出较大的变异性。例如根据笔者使用Vcaps Plus的经验,这种胶囊在溶出介质中的开口破裂时间大多在是7至10min左右(胶囊破裂时间,跟与处方相关),明显慢于明胶胶囊的2~3min。而对于变异性,囊壳破裂的时间可以在5~15min的区间变化。对于加入凝胶化助剂的HPMC胶囊,溶出行为会进一步受到介质的影响。例如加入角叉菜胶的Quali-V胶囊制剂,在钾离子和钙离子存在溶出中溶出会减慢。加入结冷胶的Vcaps在酸性溶液中会溶出减慢。对于Vcaps Plus,由于囊壳的成分中没有加入凝胶化助剂,则没有出现这些影响。
HPMC胶囊在常规溶出条件下崩解慢于明胶胶囊的原因,可能在于二者溶液性质的差异。明胶是能够在热水中溶解,在低温下则形成凝胶,在37℃的溶出条件下,明胶可以较快地溶解,因此明胶胶囊的破裂更多地来源于胶囊表面的不断的溶解;而HPMC溶液的性质却相反,低温下形成溶液,高温下形成凝胶,温度高于30℃,温度增加会明显减慢HPMC胶囊的崩解和溶出,在37℃下,囊壳表面的HPMC溶解速度明显慢于明胶,同时HPMC胶囊的含水量也明显低于明胶,囊壳的水化也需要更长的时间,这些因素造成胶囊壳的开口破裂的时间延长。
此外,即使囊壳已经发生破裂,缓慢溶解的囊壳膜也可能包裹内容物进而造成溶出的减缓。有研究者便提出了一个有趣的说法,明胶胶囊应当用热水送服,而HPMC应当采用温度低于30℃的冷水送服。所幸的是,有研究都表明,虽然HPMC胶囊的囊壳虽然会造成体内或体外的崩解迟滞,但相对于明胶胶囊,并不会影响生物利用度。
HPMC胶囊造成的溶出迟滞,并展现出较大的变异性,很显然会使其较难建立良好的体内外相关性。在发生处方工艺变更的情况下,HPMC胶囊的崩解的变异性也将使变更前后的溶出曲线比较变得困难。如果内容物的溶出本身较快,HPMC胶囊的常见取样时间点10min,甚至15min的溶出量都具有较大的变异系数,很难用于相似因子评价。若药物溶出本身很快,囊壳破裂带来的迟滞时间会给溶出量带来显著影响,在应用一些法规争取各种人体试验豁免方面将会处于劣势,例如基于BCS分类的“非常快速溶出”制剂的生物等效性豁免。
4、总结
商业化的空心胶囊是胶囊制剂开发的基础。目前最为常见的胶囊壳便是明胶空心胶囊和HPMC空心胶囊,基于其各自的处方和工艺,存在不同的优势和问题。在新药制剂的开发过程中,充分理解胶囊壳的性能和影响因素,结合被开发化合物的性质以及项目的开发目标,合理地选择胶囊壳,并针对性地设计处方,无疑会提高制剂处方工艺的稳健性,加快药物开发的进程。
(注:本文系笔者根据相关资料和自身经验整理总结所得,鉴于水平有限,难免存在谬误疏漏之处,还请读者谅解并不吝赐教。)
参考文献:
(1)Pharmaceutical Dosage Forms: Capsules, Edited by Larry L. Augsburger and Stephen W. Hoag;
(2)Developing Solid Oral Dosage Forms: Pharmaceutical Theory & Practice, Edited by Yihong Qiu, Yisheng Chen, Geoff G. Z. Zhang, Lawrence Yu and Rao V. Mantri;
(3)How to Develop Robust Solid Oral Dosage Forms: From Conception to Post-Approval, Edited by Bhavishya Mittal;
(4)Moawia M. Al-Tabakha, HPMC Capsules: Current Status and Future Prospects, J Pharm Pharmaceut Sci 13(3) 428 - 442, 2010;
(5)M. Sherry Ku and Keith Hutchison et al, Performance qualification of a new hypromellose capsule: Part I. Comparative evaluation of physical, mechanical and processability quality attributes of Vcaps Plus®, Quali-V® and gelatin capsules, International Journal of Pharmaceutics 386 (2010) 30–41;
(6)M. Sherry Kua and Yansong Chen et al, Performance qualification of a new hypromellose capsule: Part II. Disintegration and dissolution comparison between two types of hypromellose capsules, International Journal of Pharmaceutics 416 (2011) 16– 2。

来源:药事纵横 子炎


