今日头条
上海瑞宏迪下肢缺血新药获批IND。上海瑞宏迪医药自主研发的1类生物制品RGL-2102注射液获国家药监局临床许可,即将开展用于治疗下肢缺血性疾病的新药研究。RGL-2102是一款由脂质体(LNP)包载的mRNA蛋白替代疗法药物,给药后可在体内翻译得到目的人源蛋白,有潜力促进下肢缺血性疾病患者缺血下肢血管新生,建立侧枝循环,改善缺血区域的血流灌注,降低截肢或死亡风险。
国内药讯
1.康哲引进白癜风新药获批澳门上市。康哲药业从Incyte公司引进的JAK1/JAK2抑制剂磷酸芦可替尼乳膏获澳门监管部门批准上市,用于治疗12岁及以上青少年和成人患者伴面部受累的非节段型白癜风。在两项Ⅲ期临床中,与安慰剂相比,ruxolitinib治疗组第24周时患者达到面部白癜风症状改善至少75%的比例显著更高(30%vs8%)。2022年7月,该乳膏获得FDA批准,成为首个进入美国市场的白癜风疗法。
2.礼来儿童关节炎新药中国获批上市。礼来与Incyte公司合作开发的口服JAK抑制剂艾乐明(巴瑞替尼)获国家药监局批准第3项适应症,推测适应症为“幼年特发性关节炎”。在中国幼年特发性关节炎患者参与的国际III期研究(I4V-MC-JAHV)中,与安慰剂相比,巴瑞替尼治疗显著减少患者的疾病发作时间(NE vs. 27.14周,HR=0.241,p<0.0001)。此前,该新药已在中国获批用于治疗类风湿性关节炎和斑秃。
3.AZ/第一三共ADC中国II期临床积极。第一三共HER2靶向ADC德曲妥珠单抗在AACR2024年会上公布了用于中国HER2突变非小细胞肺癌(NSCLC)患者的II期研究(DESTINY-Lung05研究)积极结果。中位治疗为7.9个月时,ICR和研究者评估,确认的ORR为58.3%,DCR分别为91.7%(ICR评估)和93.1%(研究者评估);研究者评估的中位PFS为10.8个月(95% CI:7.2个月-NE)。此外,该新药在中国患者中的安全性与既往研究一致。
4.赛诺菲CD40L单抗中国获批IND。赛诺菲靶向CD40L的抗体药物frexalimab注射液获国家药监局两项临床默示许可,将分别针对复发型多发性硬化(RMS)和非复发性继发进展型多发性硬化(nrSPMS)适应症开展新药研究。Frexalimab旨在通过阻断适应性(T和B细胞)和先天性(巨噬细胞和树突状细胞)免疫细胞活化和功能所必需的共刺激CD40/CD40L细胞通路,来达到治疗MS且避免导致淋巴细胞耗竭的目的。该新药目前已处于Ⅲ期开发阶段。
5.元羿引进震颤新药获批IND。Praxis公司1类化药ulixacaltamide缓释片获国家药监局临床试验默示许可,拟开发用于治疗特发性震颤(ET)。这是一种常见的神经系统疾病,主要表现为手、头部或身体其它部分在意愿移动或静止时出现的震颤。ulixacaltamide是一款高选择性T型钙通道小分子抑制剂,元羿生物拥有其在大中华地区的开发和商业化权益。
国际药讯
1.度伐利尤单抗胆道癌长期数据积极。阿斯利康PD-L1单抗Imfinzi(度伐利尤单抗)联合化疗治疗晚期胆道癌(BTC)的III期TOPAZ-1研究获最新积极结果。中位随访为41.3个月时,与单独化疗相比,Imfinzi联合治疗显著提高了患者的总生存期(中位OS:12.9个月vs11.3个月),并将死亡风险降低26%;两组3年期生存率分别为14.6%和6.9%。此外,随访期内并未观察到新的安全信号。
2.大麻素口服复方AD激越Ⅱ期临床积极。IGC Pharma公司大麻素口服复方IGC-AD1治疗阿尔茨海默病(AD)相关激越的Ⅱ期临床获积极结果。IGC-AD1具有精神活性,旨在针对神经炎症和大麻素受体1(CB1)功能障碍。第2周激越量表(CMAI)测试数据显示,IGC-AD1治疗较安慰剂显著减轻了患者的激越症状,效应值(effect size)达到0.79(p=0.071)。此外,IGC-AD1安全性良好,未观察到剂量限制性不良事件。
3.FIC抑郁症新药Ⅲ期临床成功。Intra-Cellular公司口服5-HT2AR拮抗剂Caplyta(lumateperone)用于辅助治疗抑郁症(MDD)的Ⅲ期试验(Study 501)达到了主要和关键次要终点。在mITT人群中,与安慰剂相比,lumateperone(42mg)治疗第6周时,患者的Montgomery-Åsberg抑郁量表(MADRS)评分显著降低,两组MADRS评分相对于基线的最小二乘(LS)平均降低量分别为14.7分和9.8分(p<0.0001);患者临床整体印象-严重程度(CGI-S)评分也显著降低(p<0.0001)。药物总体耐受性良好。
4.Argenx公司FcRn拮抗剂Ⅲ期临床积极。Argenx公司公布其潜在“first-in-class”的新生Fc受体(FcRn)阻滞剂Vyvgart Hytrulo皮下注射液治疗慢性炎症性脱髓鞘性多发神经根神经病(CIDP)的Ⅲ期ADHERE试验完整结果。与安慰剂相比,Vyvgart Hytrulo治疗患者的复发风险降低了61%(HR:0.39,95% CI:0.25-0.61,p=0.000039)。今年2月,FDA已受理该新药用于治疗CIDP的sBLA申请,并授予优先审评资格,PDUFA日期为今年6月21日。
5.艾伯维19亿美元开发长效注射剂。艾伯维与Medincell公司就后者专有长效注射剂技术平台,合作开发多达6种长效注射剂(LAI),应用于多个治疗领域。根据协议,Medincell将获得3500万美元的预付款,高达19亿美元的开发和商业里程碑(每个项目3.15亿美元)的潜在付款,以及产品的特许权使用费;艾伯维将负责每个项目的临床开发,监管审批、生产和商业化。
6.武田超12亿美元开发癌症小分子。武田与Kumquat公司达成合作许可协议,联合开发新型免疫调节小分子抑制剂,用于单药或联合用药治疗难治性癌症疾病。根据协议,Kumquat将获得高达1.3亿美元的近期付款,可能超过12亿美元的临床、监管和商业里程碑潜在付款;武田将负责候选药物的Ⅰ期临床外的所有开发和商业化活动。
7.FDA暂停Neumora公司精分症药物试验。近日,FDA叫停Neumora Therapeutics公司M4毒蕈碱受体正变构调节剂NMRA-266针对精神分裂症以及其他神经精神疾病开展的Ⅰ期临床试验,原因是“此前临床前数据显示,服用该药物的兔子发生了抽搐”。受此消息影响,Neumora股价当天下跌了13%。Neumora表示,到目前为止,作为单剂量和多剂量阶段研究的一部分,30例健康受试者服用了NMRA-266,且这些患者中没有出现抽搐事件。
医药热点
1.美国“药荒”突袭,323种药物告急。据美国卫生系统药剂师协会(ASHP)和犹他州药物信息服务中心的最新数据,2024年一季度,全美有323种药物处于短缺状态,超过了2014年320种短缺的最高纪录。当前,美国的药品供应已成为不断持续且日益严重的重大问题。美国医疗卫生和经济领域的学者认为,美国大多数药物短缺的原因是药品供应链的断裂。
2.我国基本医疗保险参保人数达13.3亿人。国家医保局4月11日发布的《2023年医疗保障事业发展统计快报》中显示:截至2023年底,基本医疗保险参保人数达133386.9万人,参保覆盖面稳定在95%以上,参保质量持续提升;基本医疗保险基金(含生育保险)总收入、总支出分别为33355.16亿元、28140.33亿元;生育保险参保人数24907.06万人,同比增加300.41万人,生育保险基金待遇支出1069.10亿元,比上年增加117.75亿元,增长12.38%。
3.河南发文推动医疗装备升级改造。4月16日,河南省发布推动大规模设备更新和消费品以旧换新实施方案的通知,将实施十大重点工程。其中,在教育文旅医疗设备更新工程中,将推动医疗装备升级改造。通知指出,加强优质高效医疗卫生服务体系建设,推进各级医疗卫生机构医用设备和信息化设施迭代升级,淘汰已达使用年限、功能不全、性能落后、影响安全的医用设备。鼓励具备条件的医疗机构加快医学影像、放射治疗、远程诊疗、手术机器人等医疗装备更新改造。推动医疗机构病房改造提升,补齐病房环境与设施短板。
评审动态
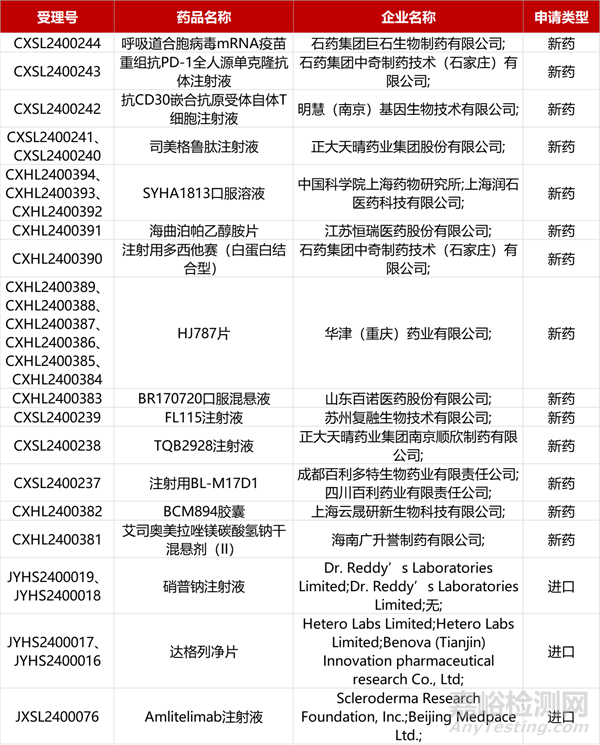
1. CDE新药受理情况(04月17日)
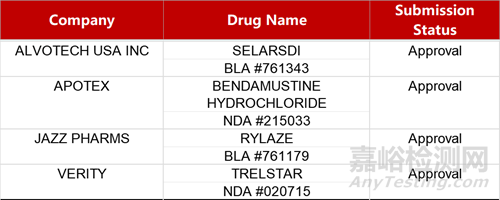
2. FDA新药获批情况(北美04月16日)