阿尔茨海默症(Alzheimer’s disease, AD)是由德国精神病和神经病理学家Alois Alzheimer在1906年首次报道,故此病用他的姓阿尔茨海默命名。阿尔茨海默症属于神经退行性疾病,多发生于 60 岁以上但也见于中年人群。此病早期症状是对近期事物记忆的衰退,接着出现烦躁、易怒、情绪改变、语言障碍,直至丧失记忆、认知功能和日常活动功能,最后导致死亡。根据《The China Alzheimer Report 2022》报告,目前我国的痴呆患者约有1507万,包括983万老年痴呆患者,392万血管性痴呆以及132万其他类型的痴呆。随着我国老龄化的进程加快,阿尔茨海默症的患者也在逐年增加。
过去20多年FDA仅批准了5款AD治疗药物,包括:他克林(Tacrine)、多奈哌齐(Donepezil)、卡巴拉汀(Revastigmine,又名利斯的明)、加兰他敏(Galantamine)和美金刚(Menantine),其中前四种为乙酰胆碱酶(AchE)抑制剂、美金刚为N-甲基-D-天冬氨酸受体拮抗剂。两者拮抗剂药物均为对症治疗,主要是改善认知和记忆障碍,并不能阻止或者延缓病情的进展。2021年6月7日FDA批准了Aducanumab(Aβ 蛋白单克隆抗体)的上市,这是继2003年之后FDA唯一批准的AD治疗药物。但是该品种有争议,此处不讨论。2019年11月2日,我国国家药品监督管理局有条件批准了甘露特钠胶囊(商品名“九期一”)上市注册申请,用于治疗轻度至中度阿尔茨海默病,改善患者认知功能。该品种也有争议,此处也不讨论。
本文主要对阿尔茨海默症一线用药盐酸多奈哌齐进行探讨。该药最早由Eisia(日本卫材)于1983年开始开发。其剂型和规格较多,主要有片剂(3mg、5mg、10mg)、口腔崩解片(3mg、5mg、10mg)、颗粒剂、干糖浆等剂型。2022年FDA批准多奈哌齐透皮贴剂,规格为5mg/天和10mg/天,一周贴一次。其用药次数减少,针对于阿尔茨海默症患者来说,极大的改善了用药顺应性。
药学研究
一、原研情况(摘自原研说明书)
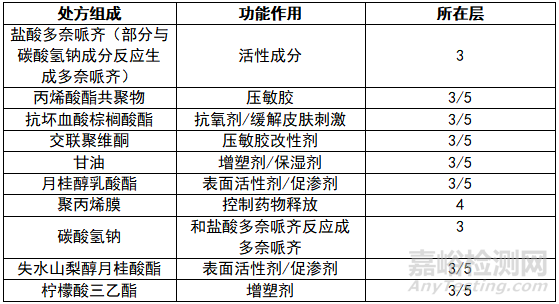
透皮贴剂为一般三层或五层贴剂,而多奈哌齐贴剂具有六层。根据多奈哌齐贴剂说明书显示如图。
第一层为包装背衬/粘合层,第二层为隔离层,第三层为药物层,第四层为微孔控释膜,第五层为皮肤粘合层,第六层为背衬层(用时撕开弃用)。
处方:多奈哌齐5mg/天和多奈哌齐10mg/天,两个规格分别含有88.4 mg或176.7 mg的多奈哌齐,分别以多奈哌齐(15%至35%)和盐酸多奈哌齐(65%至85%)的形式存在。非活性成分包括丙烯酸酯共聚物、抗坏血酸棕榈酸酯、交联聚维酮、甘油、月桂醇乳酸酯、聚丙烯膜、碳酸氢钠、失水山梨醇月桂酸酯和柠檬酸三乙酯。
用法:贴在背部(避开脊椎)。临床审查资料中说明,贴在大腿外侧,生物利用度偏低,贴在臀部,生物利用度偏高。
储存条件:2-8℃储存。
二、如何仿制?
1)原研处方分析
2)药学研发要求
具体详见CDE于2020年12月25日发布的《化学仿制药透皮贴剂药学研究技术指导原则(试行)》。
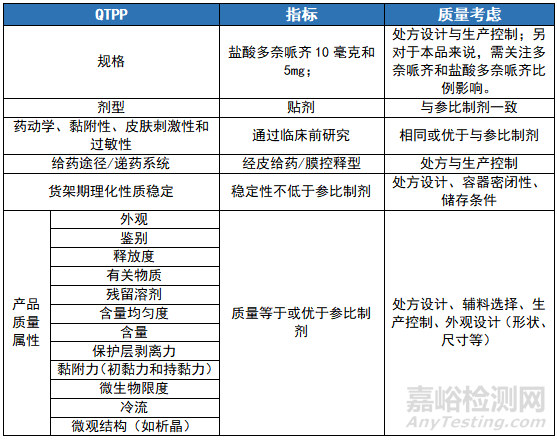
目标产品质量属性(QTPP)是透皮制剂技术开发的一个基本要素,构成了产品研发的设计基础。对于多奈哌齐贴剂项目,产品主要的QTPP属性分析如下表所示:
临床研究
一、原研情况
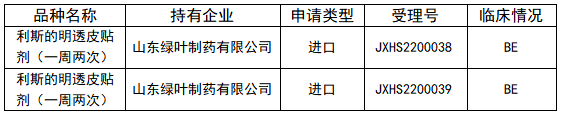
该品种在FDA 以505b2上市,属于改良型新药,临床方面做的工作为临床1期+BE,详细清单如下。

二、如何仿制?
5年内国内已经批准透皮贴剂品种的临床情况:
注:通过定制检索软件进行搜索,排除补充申请品种。
这个结果可能让很多人失望了,真正的透皮贴剂在国内自主研发获批的确实没有,申报的厂家很多,大多是观望状态,根据CDE临床登记平台数据反应,诸多的厂家都是在观望能不能做个BE获批。北京泰德的氟比洛芬贴膏是补充申请,做的大临床,湖南九典的酮洛芬贴膏也是做的大临床。这是为什么呢?
众所周知,Q1、Q2、Q3相同才有可能免临床;那么,而如何证明Q1、Q2与参比制剂一致,不仅是难度极高的贴膏、贴片,对处方相对简单的外用软膏、凝胶、乳膏等也都是难题。所以不能证明药学一致的情况下,唯有大临床才可以证明其对原研的一致性。
结论:大概率需要做大临床
集采过后,立项愈发的艰难,或许透皮制剂是一个选择,尤其是这种真真正正的对患者带来好处的品种。只是国内的设备和辅料供应商,还有配套的政策需要一定的时间去跟进。总之,应该会变好的吧。